Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. Различают 2 механизма активации ферментов указанным путём:
- активация ферментов в результате присоединения регуляторных белков
Активность некоторых ферментов регулируется специальными белками. Например, белок кальмодулин после связывания ионов кальция приобретает свойства фермента и приобретает способность активировать фосфодиэстеразу, киназу лёгких цепей миозина. Фермент плазматической мембраны клетки аденилатциклаза активируется путём присоединения одной из субъединиц G-белка, в результате чего происходит реакция образования из АТР циклического 3',5'-АМР (вторичного внутриклеточного посредника действия гормонов).
- изменение каталитической активности фермента вследствие ассоциации и диссоциации его протомеров
Некоторые ферменты-олигомеры могут изменять свою активность за счет ассоциации / диссоциации протомеров, входящих в их состав. Например, фермент протеинкиназа является олигомером, состоящим из 4 протомеров двух типов: каталитического и регуляторного. В одном протомере находится активный центр, в другом – регуляторный, который может связываться с сАМР. В ассоциированном виде фермент неактивен, так как его активный центр закрыт регуляторной субъединицей. В диссоциированном состоянии активный центр открывается и может реагировать с субстратом. Когда в клетке образуется необходимое количество сАМР, его связывание с регуляторным центром вызывает диссоциацию фермента на субъединицы, что приводит к его активации. При уменьшении концентрации сАМР он покидает регуляторный центр, что приводит к объединению субъединиц (ассоциации) и инактивации фермента.
Фосфорилирование – дефосфорилирование
Данный способ регулирования активности (принцип «включено / выключено») основан на изменении структуры фермента за счет присоединения фосфатной группы. Некоторые ферменты, присоединяя (процесс фосфорилирования) или отщепляя (процесс дефосфорилирования) остаток фосфорной кислоты, могут изменять свою активность (рис. 5.10). Фосфорилирование ферментов в клетке происходит с участием протеинкиназы. Остаток фосфорной кислоты чаще всего связывается с боковой группой остатков серина или треонина. Если в клетке активна фосфопротеинфосфатаза, – протекает противоположный процесс (дефосфорилирование).
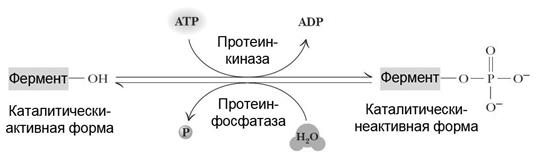
| Рис. 5.10. | Ковалентная модификация ферментов, осуществляемая путём фосфорилирования / дефосфорилирования. |
Активность протеинкиназ и фосфопротеинфосфатаз находится под гормональным контролем и регулируется также нервной системой.
В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Например, активность ферментов гликогенсинтазы (фермент биосинтеза гликогена) и гликогенфосфорилазы (фермент распада гликогена) регулируется путем фосфорилирования / дефосфорилирования. Природа данных ферментов такова, что фосфорилированная форма гликогенфосфорилазы активна, а гликогенсинтазы – неактивна. При дефосфорилировании их активности меняются на противоположные. Биологический смысл заключается в том, что когда происходит биосинтез гликогена, его распад ингибируется, и наоборот.
 2015-06-26
2015-06-26 4908
4908








