1) В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Большинство
природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами
и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом.
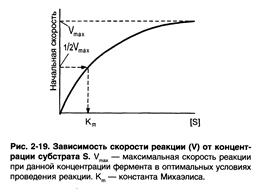
2) 

3) АТФ является накопителем энергии. Энергия заключается в макроэргических связях. Связи образуются между фосфорными остатками в молекуле АТФ. (Только это)
4) Единица активности фермента – это такое количество фермента, которое катализирует превращение 1 мкмоль вещества за 1 мин. Определяется по формуле
Количество превращенного субстрата, мкмоль/навеска ткани, г*время инкубации, мин= nE
5) АТФ-синтетаза – очень крупный олигомерный белок, в котором выделяют три части: выступающую в матрикс митохондрии (F1), построенную из трех пар димеров альфа-бета; трансмембранную часть (F0), Образующую гидрофильный канал, и промежуточную область FA. АТФ-синтетаза катализирует синтез АТФ из АДФ и фосфорной кислоты.
Субъединица F1 содержит активные центры, синтезирующие АТФ. Протоны движутся через канал АТФ-синтазы, и энергия этого движения используется для образования АТФ. Конкретные механизмы сопряжения, т.е. трансформации электрохимического потенциала в энергию макроэргической связи АТФ, все еще не вполне ясны.
Билет 9.
1) Классификация ферментов:
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза,алкогольдегидрогеназа.
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза,липопротеинлипаза.
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза АТФ. Пример:ДНК-полимераза

2)Виды специфичности ферментов.Примеры.
Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия.
Субстратная специфичность, это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
· абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата;
· относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов;
· стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
 2015-06-26
2015-06-26 673
673








