1) Ингибирование ферментов. Ингибитор – это вещество, вызывающее специфическое снижение активности фермента. Следует различать ингибирование и инактивацию. Инактивация – это, например, денатурация белка в результате действия денатурирующих агентов.
По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые. Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активности. Все процедуры по очистке белка не влияют на связь ингибитора и фермента. Пр.: действие фосфорорганических соединений на фермент – холинэстеразу. Хлорофос, зарин, зоман и др. фосфорорганические соединения связываются с активным центром холинэстеразы. В результате происходит фосфорилирование каталитических групп активного центра фермента. В следствии молекулы фермента, связанные с ингибитором, не могут связываться с субстратом и наступает тяжелое отравление.
Также выделяют обратимые игнибиторы, например прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата.
По механизму действия выделяют:
- конкурентное ингибирование;
- неконкурентное ингибирование;
- субстратное ингибирование;
- аллостерическое.
1) Конкурентное (изостерическое) ингибирование – это торможение ферментативной реакции, вызванное связыванием ингибитора с активным центром фермента. При этом ингибитор имеет сходство с субстратом. В процессе происходит конкуренция за активный центр: образуются фермент-субстратные и ингибитор-ферментные комплексы. E+SES EP E+P; E+I E. Пр.: сукцинатдегидрогеназная реакция [рис. COOH-CH2-CH2-COOH(над стрелкой СДГ, под ФАДФАДН2) COOH-CH=CH-COOH]. Истинным субстратом этой реакции является сукцинат (янтарная к-та). Ингибиторы: малоновая к-та (COOH-CH2-COOH) и оксалоацетат (COOH-CO-CH2-COOH). [рис. фермента с 3 дырками+ субстрат+ ингибитор= комплекс ингибитора с ферментом]
Пр.: фермент холинэстераза катализирует превращение ацетилхолина в холин: (CH3)3-N-CH2-CH2-O-CO-CH3 (над стрелкой ХЭ, под – вода) CH3СOOH+(CH3)3-N-CH2-CH2-OH. Конкурентными ингибиторами являются прозерин, севин.
2) Неконкурентное ингибирование – торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание фермента с субстратом. В этом случае ингибитор может связываться и с активным центром (каталитический участок) и вне его.
Присоединение ингибитора вне активного центра приводит к изменению конформации (третичной структуры) белка, вследствие чего изменяется конформация активного центра. Это затрагивает каталитический участок и мешает взаимодействию субстрата с активным центром. При этом ингибитор не имеет сходства с субстратом и это ингибирование нельзя снять избытком субстрата. Возможно образование тройных комплексов фермент-ингибитор-субстрат. Скорость такой реакции не будет максимальной.
К неконкурентным ингибиторам относят:
- цианиды. Они связываются с атомом железа в цитохромоксидазе и в результате этого фермент теряет свою активность, а т.к. это фермент дыхательной цепи, то нарушается дыхание клеток и они гибнут. - ионы тяжёлых металлов и их органические соединения (Hg, Pb и др.). Механизм их действия связан с соединением их с различными SH-группами. [рис. фермента с SH-группами, иона ртути, субстрата. Все это соединяется в тройной комплекс]
- ряд фармакологических средств, которые должны поражать ферменты злокачественных клеток. Сюда же относятся ингибиторы, использующиеся в сельском хозяйстве, бытовые отравляющие вещества.
3) Субстратное ингибирование – торможение ферментативной реакции, вызванное избытком субстрата. Происходит в результате образования фермент-субстратного комплекса, неспособного подвергаться каталитическому превращению. Его можно снять и уменьшить концентрацию субстрата. [рис. связывания фермента сразу с 2 субстратами]
4) Аллостерическое ингибирование – торможение ферментативной реакции, вызванное присоединением аллостерического ингибитора в аллостерическом центре аллостерического фермента. Такой тип ингибирования характерен для аллостерических ферментов, имеющих четвертичную структуру. В качестве ингибиторов могут выступать метаболиты, гормоны, ионы металлов, коферменты.
Механизм действия:
а) присоединение ингибитора к аллостерическому центру;
б) изменяется конформация фермента;
в) изменяется конформация активного центра;
г) нарушается комплиментарность активного центра фермента к субстрату;
д) уменьшается число молекул ES;
е) уменьшается скорость ферментативной реакции.
[рис. фермент с 2 дырками, к одной аллостерический ингибитор и вторая меняет форму]
К особенностям аллостерических ферментов относят ингибирование по отрицателтной обратной связи. A(E1)B(E2) C(E3) D (от D стрелочка к стрелке между А и В). D – метаболит, действующий как аллостерический ингибитор на фермент Е1.
при конкурентном ингибировании увеличивается константа Михаэлиса, а максимальная скорость ферментативной реакции остается неизменной.
При неконкурентном ингибировании максимальная скорость реакции уменьшается, а константа Михаэлиса остается неизменной.
Пенициллин, одно из самых известных и распрстраненных лекарств, применяется для лечения ряда инфекционных заболеваний. Пенициллин необратимо ингибирует фермент бактерий гликопептид-трансферазу. Этот фермент участвует в синтезе бактериальной стенки, и поэтому в присутствии пенициллина размножение бактерий невозможно. Гликопептид-трансфераза содержит остаток серина в активном центре (сериновая петид-гидролаза) В МОЛЕКУле пенициллина есть амидная связь, по свойствам сходная с пептидной связью. В результате разрыва этой связи, катализируемого ферментом, остаток пенициллина оказывается необратимо связанным с ферментом.
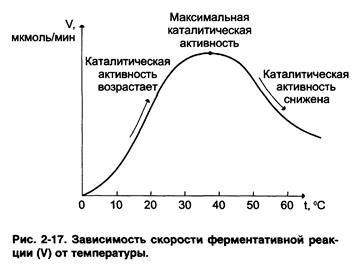
2) Скорость ферментативных реакций, как всяких других, зависит от температуры: при повышении температуры на каждые 10 градусов С скорость увеличивается примерно вдвое. Однако для ферментативных реакций это правило справедливо лишь в области низких температур – до 50-60градусов.Приболее высоких температурах ускоряется денатурация фермента, что означает уменьшение его количества; соответственно снижается и скорость реакции. При 80-90 градусах большинство ферментов денатурируется практически мгновенно. Количественное определение ферментов рекомендуется проводить при 25 градусах.
 2015-06-26
2015-06-26 962
962








