В ферменте выделяют 2 части:1)активный центр -уникальная комбинация Акных остатков,который принимает участие в ферм.р-ях.Состоит из:
-якорной площадки,который имеет высокое сродство с субстратом.
-каталитический центр,который отвечает за саму р-ю.
2)аллостерический центр связывает обычные низкомолекулярные вещества,молекулы,которые отличаются по структуре от субстратов.Присоединение сюда эффектора изменяет конфигурацию активного центра и снижает или повышает экзиматическую активность.
Сериновые протеазы (сериновые эндопептидазы) — ферменты, способные разрезать белки рассечением пептидных связей и отличающиеся от других протеаз наличием в своём активном центре аминокислоты серина. Сериновые протеазы содержатся как в многоклеточных, так и в одноклеточных организмах, они есть как у эукариотов, так и у прокариотов. Пример: Трипсин • Химотрипсин • Эластаза.
2. Кривая уравнения Михаэли-
са-Ментен: гиперболическая зависи-
мость начальных скоростей катализиру-
емой ферментом реакции от концентра-
ции субстрата.
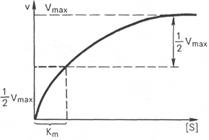
Km-констатнта Михаэлиса-это та концентрация субстрата,при котором скорость Vo=1\2Vmax.Чем больше величина Кm,тем медленнее происходит "насыщение"фермента,т.е. тем меньше его сродство к субстрату.
Одним из наиболее существенных факторов, определяющих скорость ферментатив-
ной реакции, является концентрация субстрата (или субстратов) и продукта
(продуктов). При постоянной концентрации фермента скорость реакции
постепенно увеличивается, достигая определенного максимума
, когда дальнейшее увеличение количества субстрата практически
не оказывает влияния на скорость ферментативной реакции. В таких
случаях принято считать, что субстрат находится в избытке, а фермент
полностью насыщен, т.е. все молекулы фермента связаны с субстратом.
Ограничивающим скорость реакции фактором в последнем случае ста-
новится концентрация фермента. Именно при этих условиях определяют
величину максимальной скорости (Vmax) и значения константы Михаэлиса
(Km)
3.
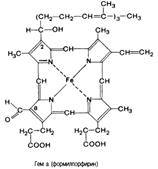
ЦИТОХРОМЫ, сложные белки — переносчики электронов, простетическая группа которых представлена гемом. Содержатся в клетках всех организмов. Локализованы в мембранах митохондрий, хлоропластов, хроматофоров, эндоплазматического ретикулума и в других мембранных структурах, участвуют во всех основных группах окислительно-восстановительных процессов, протекающих в живых клетках, — дыхании, фотосинтезе, микросомальном окислении. Как правило, образуют так называемые цепи, по которым электроны последовательно переносятся от донора к конечному акцептору. При функционировании цитохромов и переносе восстановительных эквивалентов обратимо изменяется уровень окисления простетической группы [Fe(II) <—> Fe(III)]. Формула простетической группы цитохрома.
4. α-амилаза гидролизует крахмал с образованием конечных
продуктов, не дающих цветной реакции с йодом. При взаимодействии крахмала с йодом
образуется окрашенный комплекс, оптическая плотность которого при 640 нм
пропорциональна концентрации негидролизированного крахмала. Активность α-амилазы
оценивают по уменьшению интенсивности окраски. Активность α-амилазы выражают в
миллиграммах или граммах крахмала, гидролизованного 1 л исследуемого образца за
1 сек инкубации при 37 oС.
5.
Дыхательная цепь представляет собой ряд белковых комплексов, встроенных во внутреннюю митохондриальную мембрану (рис. 210). Существуют три главных ферментных комплекса. Первый, НАД·Н-дегидрогеназный комплекс принимает электроны от НАД·Н и переносит их во второй комплекс — комплекс Ь—с1 который в свою очередь переносит их на цитохромоксидазный комплекс, а он их передает на кислород, в результате чего образуется вода. На этом окисление заканчивается. Цитохромоксидаза переносит электороны с цитохрома с на кислород, помимо гема содержит ионы меди,которые,меняя валентность,участвуют в переносе электронов.
Субстратом для комплекса 1 и 2 являюся органические вещества.
Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2.
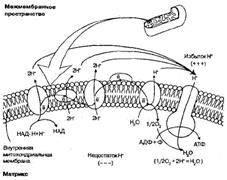 Цианид блокирует движение электронов, тем самым угнетая утилизацию кислорода. Нарушается функция клеток и наступает смерть.
Цианид блокирует движение электронов, тем самым угнетая утилизацию кислорода. Нарушается функция клеток и наступает смерть.
 2015-06-26
2015-06-26 1046
1046








