1. Інформація, що наноситься на упаковку (етикетку).
1.1. На вторинній упаковці лікарського засобу, а за її відсутності – на первинній упаковці вказуються такі відомості:
а) штрих-код лікарського засобу;
б) назва лікарського засобу, яка супроводжується зазначенням міжнародної непатентованої або у разі її відсутності загальноприйнятої назви (коли препарат містить лише одну діючу речовину); якщо назва лікарського засобу може застосовуватися у декількох лікарських формах та/або мати різну силу дії, то необхідно вказати лікарську форму та/або силу дії із зазначенням того, чи призначений цей лікарський засіб для дітей віком до 1 року, старше 1 року або дорослих;
в) зазначення діючих речовин у якісному та кількісному вираженні, з указанням їхнього вмісту в одиниці дози або, залежно від способу застосування, в одиниці об‘єму чи маси, з використанням їх міжнародних непатентованих або загальноприйнятих назв;
г) лікарська форма із зазначенням маси, об'єму або кількості одиниць дозування, що містяться в упаковці;
ґ) перелік допоміжних речовин (пункт 6.1 цього додатка), стосовно яких відомо, що вони спричиняють певну дію або ефект і їх назви вказуються разом з формулюванням: «для докладної інформації див. інструкцію для медичного застосування». Однак на упаковці повинні бути вказані всі допоміжні речовини, якщо лікарський засіб використовується парентерально, або в офтальмологічній практиці, або для місцевого застосування (нашкірні та трансдермальні препарати, лікарські засоби для інгаляцій, для ротової порожнини, назальні, ректальні та вагінальні лікарські засоби, тобто такі, що мають місцеву або трансдермальну дію);
д) спосіб, а за необхідності і шлях введення лікарського засобу;
е) особливі застереження відносно того, чи слід зберігати лікарський засіб у недоступному для дітей місці і, за необхідності – поза полем зору дітей;
є) дата закінчення терміну придатності (місяць/рік);
ж) за необхідності особливі вказівки відносно того, що робити з невикористаним лікарським засобом або відходами, які залишаються після використання такого препарату, а також, за бажанням заявника, посилання на будь-яку придатну систему збирання відходів на місці;
з) назва та місцезнаходження виробника та/або заявника і за необхідності назва представництва, призначеного цим заявником;
и) реєстраційний номер;
і) номер серії лікарського засобу, присвоєний виробником;
ї) якщо лікарський засіб призначений для самостійного лікування, інформація для його застосування;
й) за необхідності особливі застереження стосовно лікарського засобу;
к) за необхідності особливі умови зберігання.
У разі відсутності відповідної площі на упаковці для нанесення повної інформації обов'язково наносяться дані, перелічені в підпунктах «a», «б», «в», «г», «є», «з», «і», за умови наявності листка-вкладиша.
1.2. На вторинній упаковці можуть бути також вміщені символи або піктограми, які дають змогу пояснити інформацію, вказану в пункті 1 цього додатка, а також інша інформація, яка відповідає короткій характеристиці лікарського засобу та є корисною для пацієнта, за винятком будь-яких елементів, які сприяють просуванню даного препарату на ринку.
1.3. Зазначена у пунктах 1.1 та 1.2 цього додатка інформація вказується на всіх первинних упаковках за винятком випадків, описаних у пункті 1.4 цього додатка.
1.4. На первинній упаковці у формі блістера, стрипа тощо та на первинній упаковці невеликого розміру (ампулі, тюбику-крапельниці, шприці-тюбику тощо), що вкладається у вторинну упаковку, яка відповідає вимогам, викладеним у пунктах 1.1 та 1.2 цього додатка, вказується, як мінімум, така інформація:
- назва лікарського засобу (українською та/або російською, та/або англійською мовою, та/або латиною);
- маса, об'єм, концентрація або кількість одиниць дії лікарського засобу;
- номер серії лікарського засобу;
- дата закінчення терміну придатності;
- назва виробника та/або заявника.
У разі відсутності відповідної площі на первинній упаковці для нанесення зазначеної інформації обов'язково вказуються дані, перелічені в перших трьох пунктах.
2. Вторинна упаковка та первинна упаковка лікарських засобів, що містять радіонукліди, повинні бути марковані відповідно до Правил безпечного транспортування радіоактивних матеріалів, установлених Міжнародною агенцією з атомної енергії, та відповідати таким вимогам:
2.1. Етикетка на захисному контейнері повинна містити докладні відомості, вказані в пункті 1.1 цього додатка. Додатково маркування на захисному контейнері повинно повністю пояснювати кодування на флаконі та за необхідності містити зазначення кількості одиниць радіоактивності препарату у дозі або цілому флаконі з указанням дати, а у разі необхідності часу, а також кількості капсул або для рідини - об'єм у мілілітрах вмісту флакона.
2.2. Маркування флакона повинно містити таку інформацію:
- назву або код лікарського засобу, включаючи назву або хімічний символ радіонукліда;
- номер серії та дату закінчення терміну придатності;
- міжнародний символ радіоактивності;
- назву виробника;
- кількість одиниць радіоактивності, як указано в пункті 2.1 цього додатка.
3. Для гомеопатичних лікарських засобів, які відповідають умовам, викладеним у додатку 11 до пункту 6.6 Порядку, на етикетці повинна бути наведена така інформація (і жодної іншої):
- штрих-код лікарського засобу;
- наукова назва сировини або видів сировини з наступним зазначенням ступеня розведення із застосуванням символів Державної фармакопеї України (далі – ДФУ) або іншої визнаної в Україні фармакопеї;
- назва та місцезнаходження виробника та/або заявника і за необхідності назва представництва, призначеного цим заявником;
- спосіб застосування та, за необхідності, шлях введення;
- дата закінчення терміну придатності (місяць/рік);
- лікарська форма;
- вміст упаковки для продажу;
- за необхідності особливі умови зберігання;
- за необхідності особливі застереження щодо лікарського засобу;
- номер серії лікарського засобу, присвоєний виробником;
- реєстраційний номер;
- формулювання «гомеопатичний лікарський засіб без затверджених терапевтичних показань для застосування»;
- застереження для споживача про необхідність консультації з лікарем, якщо симптоми захворювання не зникли під час застосування препарату.
4. Для традиційних лікарських засобів рослинного походження етикетка повинна містити докладні відомості, вказані в пунктах 1.1 та 1.2 цього додатка. Додатково повинні бути наведені вказівки про те, що:
- препарат є традиційним лікарським засобом рослинного походження для використання відповідно до показань, підтверджених тривалим застосуванням;
- користувач повинен проконсультуватися з лікарем, якщо симптоми захворювання не зникли під час застосування лікарського засобу або спостерігаються побічні реакції, не вказані в інструкції для медичного застосування.
5. Основні вимоги до нанесення текстів.
Дані на упаковці мають бути нанесені шрифтом не менше 7 пунктів Дідо.
Допускається викладення інформації декількома мовами, одна з яких визначена законодавством України як мова міжнаціонального спілкування, за умови ідентичності інформації.
На первинних упаковках невеликого розміру (пункт 1.4 цього додатка) дані мають бути наведені українською та/або російською, та/або англійською мовою, та/або латиною.
Допускається за необхідності нанесення на упаковку інформації за допомогою стикера, текст якого затверджено Державним фармакологічним центром (далі – Центр).
6. Вимоги щодо допоміжних речовин, які мають бути нанесені на упаковку.
6.1. Перелік допоміжних речовин, які мають бути обов'язково вказані на упаковці:
| ▫ Апротинін | ▫ Спирт цетостеариловий |
| ▫ Олія арахісова | ▫ Спирт цетиловий |
| ▫ Аспартам (Е 951) | ▫ Хлоркрезол |
| ▫ Азобарвники: | ▫ Диметилсульфоксид |
| - тартразин (Е 102) | ▫ Етанол |
| - жовтий захід FCF (Е 110) | ▫ Формальдегід |
| - азорубін, кармоїзин (Е 122) | ▫ Фруктоза |
| - амарант (Е 123) | ▫ Галактоза |
| - понсо 4R (пунцовий 4R), кошеніль червона А (Е 124) | ▫ Глюкоза |
| - діамантовий чорний BN, чорний PN (Е 151) | ▫ Гліцерин |
| ▫ Перуанський бальзам | ▫ Гепарин |
| ▫ Бензалконію хлорид | ▫ Цукор інвертний |
| ▫ Кислота бензойна та бензоати: | ▫ Лактит (Е 966) |
| - кислота бензойна (Е 210) | ▫ Лактоза |
| - натрію бензоат (Е 211) | ▫ Ланолін |
| - калію бензоат (Е 212) | ▫ Латекс |
| ▫ Спирт бензиловий | ▫ Мальтит (Е 965) |
| ▫ Олія бергамота | ▫ Ізомальтитол (Е 953) |
| ▫ Бронопол | ▫ Мальтит рідкий |
| ▫ Бергаптен | ▫ Маніт (Е 421) |
| ▫ Бутилгідроксіанізол (Е 320) | ▫ Органічні сполуки ртуті: |
| ▫ Бутилгідрокситолуол (Е 321) | - тіомерсал |
| ▫ Олія рицинова поліетоксильована | - фенілртуті нітрат |
| ▫ Олія рицинова поліетоксильована, гідрогенізована | - фенілртуті ацетат |
| ▫ Парагідроксибензоати та їх ефіри: | - фенілртуті борат |
| - етилпарагідроксибензоат (Е 214) | ▫ Олія соєва, олія соєва гідрогенізована |
| - пропілпарагідроксибензоат (Е 216) | ▫ Спирт стеариловий |
| - натрію пропілпарагідроксибензоат (Е 217) | ▫ Цукроза (сахароза) |
| - метилпарагідроксибензоат (Е 218) | ▫ Сульфіти, включаючи метабісульфіти: |
| - натрію метилпарагідроксибензоат (Е 219) | - сірки діоксид (Е 220) |
| ▫ Фенілаланін | - натрію сульфіт (Е 221) |
| ▫ Калій | - натрію гідросульфіт (Е 222) |
| ▫ Пропіленгліколь та ефіри | - натрію метабісульфіт (Е 223) |
| ▫ Олія кунжутна | - калію метабісульфіт (Е 224) |
| ▫ Натрій | - калію гідросульфіт (Е 228) |
| ▫ Кислота сорбінова та її солі | ▫ Крохмаль пшеничний |
| ▫ Сорбіт (Е 420) | ▫ Ксиліт. |
6.2. Назви допоміжних речовин на упаковці повинні вказуватись у такий спосіб:
▫ допоміжні речовини мають бути представлені за їхніми міжнародними непатентованими назвами (далі - МНН) відповідно до Європейської Фармакопеї, або за відсутності таких - загальноприйнятими назвами.
▫ назву допоміжної речовини має супроводжувати номер “Е”, якщо такий є. На упаковці може бути зазначений тільки номер “Е” за умови, що повна назва (МНН, а за її відсутності – загальноприйнята назва) та номер “Е” буде наведено в інструкції для медичного застосування у розділі, де зазначено повний якісний склад.
▫ патентовані коригенти або ароматизатори мають бути надані у загальноприйнятих термінах (наприклад, «апельсиновий смак», «лимонний аромат»); мають бути зазначені будь-які відомі основні компоненти або такі, що мають певну визнану дію або реакцію.
▫ хімічно модифіковані допоміжні речовини мають бути вказані у такий спосіб, аби уникнути плутанини з немодифікованими допоміжними речовинами (наприклад, крохмаль прежелатинізований).
▫ усі компоненти складних допоміжних речовин або сумішей мають бути заявлені, перелічені в описі загального складу із зазначенням основних складових речовин (наприклад, фарба для друку, що містить x, y, z). Загальна назва складної допоміжної речовини або суміші може бути використана на упаковці у випадку, якщо більш повна інформація надається в інструкції для медичного застосування. Будь-який компонент, здатний спричинити певну дію або реакцію, має бути вказаний на упаковці.
Ці вимоги не стосуються маркування на упаковках діючих речовин і встановлюються в матеріалах реєстраційного досьє.
Директор ДП «Державний фармакологічний центр»
МОЗ України В.Т. Чумак
Публікації документа:
Офіційний вісник України вiд 05.10.2007 - 2007 р., № 72, стор. 131, стаття 2714, код акту 41039/2007
Приложение 2
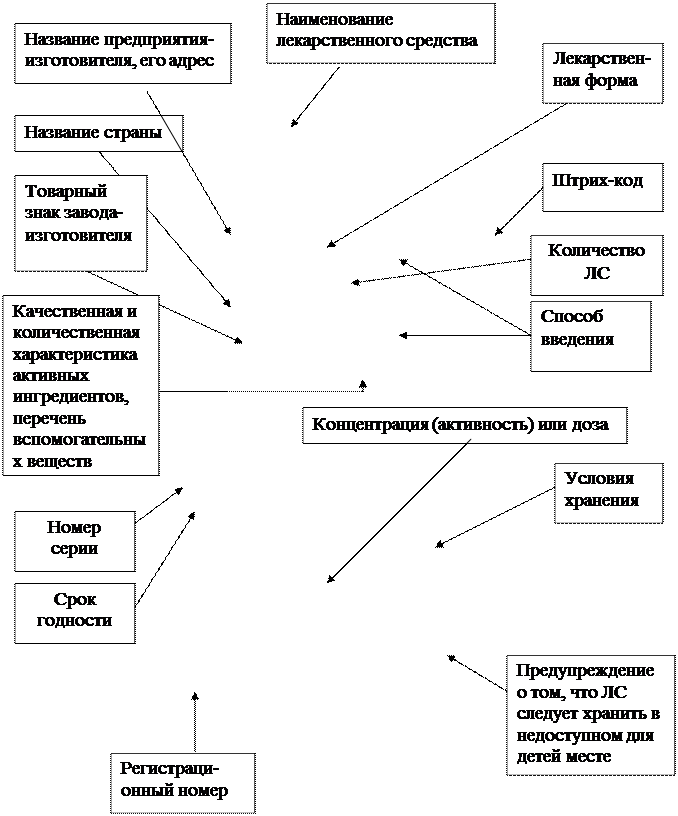

Рисунок 1. Графическое оформление вторичной упаковки ГЛС
Приложение 3
 2015-06-28
2015-06-28 1114
1114








