Общее понятие о химическом эквиваленте. Из пропорциональности количеств элементов и веществ, участвующих в химической реакции, следует, что данному количеству одного из элементов или веществ соответствует определенное количество другого из них. Такие количества называются эквивалентными (равноценными) количествами.
Взятые применительно к установленному стандарту, эквивалентные количества элементов и веществ носят название химических эквивалентов. Впервые понятие об эквиваленте введено в науку в начале XIX в. по отношению к реакциям соединения элементов друг с другом или замещения их друг другом. В дальнейшем это понятие было распространено на все типы реакций.
Из законов кратных отношений и простых объемных отношений с учетом постоянства состава вещества следует, что химические соединения вступают в реакции между собой в определенном количественном соотношении. Следовательно, для простоты расчетов можно принять определенное вещество, его количество или его часть за единицу (эквивалент) и через нее выражать количества других веществ. В качестве такой единицы был принят один атом водорода (или один электрон).
Эквивалентом называется реальная или условная частица вещества, которая может присоединять, высвобождать или быть эквивалентной одному атому водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
В химических соединениях эквивалент вещества (фактор эквивалентности) рассчитывается по формуле:
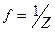 . (12)
. (12)
Здесь Z равно:
1) числу атомов водорода в бинарном водородсодержащем соединении; числу кислотных протонов в молекуле кислоты;
2) степени окисления атома металла в молекуле основания;
3) числу ионов металла, умноженному на степень их окисления, в молекуле соли;
4) числу атомов элемента, умноженному на степень его окисления, в молекуле оксида.
В химических реакциях эквивалент показывает, какая часть атома, молекулы или иона эквивалентна 1 иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях). Эквивалент данного соединения зависит от конкретной реакции, в которой оно участвует.
Примеры.
H3PO4 + NaOH →NaH2PO4 + H2O f(H3PO4) = 1/1=1
H3PO4 + 2NaOH →Na2HPO4 + 2H2O f(H3PO4) = 1/2
H3PO4 + 3NaOH →Na3PO4 + 3H2O f(H3PO4) = 1/3
MnO4- + 5e = Mn2+ (кислая среда) f(КМnO4) = 1/5
MnO4- + 1e = MnO42- (щелочная среда) f(КМnO4) = 1/1=1
MnO4- + 3e = MnO2 (нейтральная среда) f(КМnO4) = 1/3
Молярная масса эквивалента (эквивалентная масса) — это масса 1 моля эквивалентов вещества. Она рассчитывается по формуле:
М(1/z) = МХ ·fХ = М·(1/z) (г/моль·экв.). (13)
Количество вещества эквивалента любого соединения n(1/z) рассчитывается делением массы вещества на молярную массу его эквивалента:
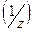 =
= 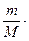
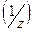 = n·z. (14)
= n·z. (14)
Эквивалентный объем (для газообразных веществ) — это объем 1 моля эквивалентов вещества. Он рассчитывается по формуле:
V 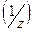 = V· f= V·
= V· f= V· 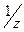 . (15)
. (15)
ПРИМЕР.
Эквивалентный объем водорода при нормальных условиях равен^
V0(1/z Н2) = VO2 = 22,4: 2 = 11,2 л.
В 1800 г. немецкий химик И. В. Рихтер ввел закон эквивалентных отношений.
Массы веществ, реагирующих без остатка, относятся друг к другу как молярные массы их эквивалентов.
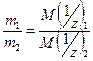 (16)
(16)
Отсюда следует, что если известны массы взаимодействующих веществ и молярная масса эквивалента одного из них, то можно определить молярную массу эквивалента другого по формуле:
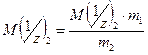
Следствие из этого закона: к оличества веществ эквивалентов всех участников реакции равны.
Из уравнения 16 следует:
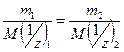 .
.
Отсюда с учетом уравнения 14 получаем искомое следствие:
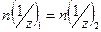 . (17)
. (17)
Эквиваленты элементов в реакциях соединения и замещения. При соединении элементов друг с другом и при замещении одних элементов другими в качестве исходного эквивалента берут 8 (точнее 7,9997) единиц массы кислорода или 1 (точнее 1,00797) единицу массы водорода. Поэтому эквивалентом элемента в реакциях этого типа считается количество элемента, соединяющееся с 8 единицами массы кислорода или с 1 единицей массы водорода или замещающее эти количества в соединениях.
Эквивалент элемента может быть вычислен не только по кислороду или водороду, но и по любому другому элементу, с которым он вступает в реакцию. Для этого нужно знать, кроме количеств участвующих в реакции элементов, еще эквивалент элемента, по которому производится расчет.
Например, эквивалент алюминия равен 9, так как его атомный вес 27, а валентность 3; эквивалент меди в соединениях, в которых она одновалентна, равен 63,57, а в соединениях, в которых она проявляет валентность 2, он равен 31,78. Исходя из этой зависимости можно по экспериментально найденному эквиваленту и атомному весу элемента вычислить валентность его в данном соединении.
Зависимость эквивалента элемента от атомной массы элемента и его валентности. Для рассматриваемого типа реакций и соединений эквивалент элемента численно равен частному от деления атомного веса А элемента на проявляемую им валентность п:
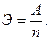
Вычисление эквивалентов электролитов по экспериментальным данным. Для вычисления надо знать количества участвующих в реакции веществ и эквивалент одного из них. Расчет производится по закону эквивалентов.
 2015-06-28
2015-06-28 12059
12059
