Если макросистема находится в неравновесном состоянии, то она самопроизвольно будет переходить в состояние с большей вероятностью – равновесное. Вместе с тем, согласно второму началу термодинамики все самопризвольные процессы сопровождаются возрастанием энтропии. Поэтому между энтропией и вероятностью в каждом состоянии должна быть связь. Эта идея, высказанная Больцманом, оправдалась и оказалась весьма плодотворной.
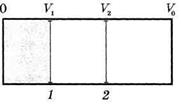 Для нахождения этой связи рассмотрим необратимый процесс расширения идеального газа в пустоту. Для нахождения этой связи рассмотрим необратимый процесс расширения идеального газа в пустоту. |
Пусть данный газ первоначально находится в объеме 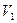 теплоизолированного сосуда объемом
теплоизолированного сосуда объемом 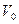 (рис.2). От остальной части сосуда он отделен перегородкой.
(рис.2). От остальной части сосуда он отделен перегородкой.
Перегородку практически мгновенно перемещают из положения 1 в положение 2, газ расширяется в пустоту до объема 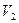 и приходит в равновесное состояние. При этом работу газ на совершает, А =0, переданное газу тепло равно нулю,
и приходит в равновесное состояние. При этом работу газ на совершает, А =0, переданное газу тепло равно нулю, 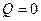 , и по первому началу термодинамики приращение внутренней энергии равно нулю,
, и по первому началу термодинамики приращение внутренней энергии равно нулю, 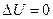 , т.е. температура начального и конечного состояний одинакова.
, т.е. температура начального и конечного состояний одинакова.
Так как энтропия – функция состояния, ее приращение в этом процессе можно вычислить по обратимому процессу, например, изотермическому.
В изотермическом процессе:
теплота 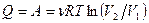 , поэтому
, поэтому
изменение энтропии 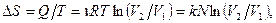
где 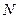 - число молекул в газе.
- число молекул в газе.
В рассмотренном процессе распределение по скоростям в начальном и конечном состояниях одинаково (так как температура не изменилась). Пространственное же распределение молекул стало более “свободным”, значит, более вероятным.
Действительно, вероятность нахождения
· одной молекулы газа в объеме 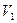 равна
равна 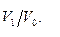
· всех N молекул собраться в объеме 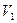 равна
равна 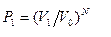 .
.
· в объеме 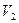
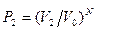 .
.
Отношение этих вероятностей 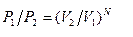 , тогда
, тогда
приращение энтропии 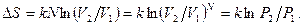
Вероятность макросистемы пропорциональна статистическому весу, 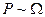 ,
,
тогда
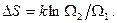
и энтропия 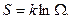 - это формула Больцмана, связывающая энтропию (чисто физическую величину) со статистическим весом.
- это формула Больцмана, связывающая энтропию (чисто физическую величину) со статистическим весом.
Рассмотрим макросистему, состоящую из двух невзаимодействующих подсистем,
1 - одна из которых находится в состоянии 1 с энтропией 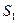 и статистическим весом
и статистическим весом 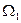 ,
,
2 - другая – в состоянии 2 с энтропией 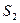 и статистическим весом
и статистическим весом 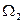 .
.
Число способов (микросостояний), реализующий рассматриваемое макросостояние, равно 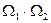 .
.
Тогда 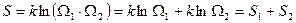
- энтропия системы равна сумме энтропий ее частей, т.е. энтропия - величина аддитивная.
Принцип возрастания энтропии со статистической точки зрения привел Больцмана к фундаментальному выводу: в се замкнутые макросистемы стремятся переходить от состояний менее вероятных к более вероятным.
- При этом сама энтропия 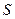 характеризует степень беспорядка в макросистеме: состояниям с большим беспорядком отвечает большая вероятность (статистический вес), чем у более упорядоченного состояния.
характеризует степень беспорядка в макросистеме: состояниям с большим беспорядком отвечает большая вероятность (статистический вес), чем у более упорядоченного состояния.
- Чем выше степень беспорядка в координатах и скоростях частиц, тем больше вероятность Ω того, что система будет находиться в состоянии беспорядка.
- Система находится в состоянии с большей вероятностью чаще, чем в состоянии с меньшей вероятностью.
- Система, первоначально находившаяся в состоянии с малой вероятностью, будет стремиться к состоянию, в котором вероятность больше.
- С ростом термодинамической вероятности растёт энтропия S, поэтому изменение энтропии S должно быть положительным dS >0.
- Энтропия изолированной системы при протекании необратимого процесса возрастает, т.е. изолированная система переходит из менее вероятных состояний в более вероятные, поэтому величина S растёт.
- Энтропия системы, находящейся в равновесном состоянии, максимальна.
Учитывая сказанное можно придти к уточнённой формулировке закона возрастания энтропии: при всех происходящих в замкнутой системе тепловых процессах, энтропия системы возрастает, максимально возможное значение энтропии замкнутой системы достигается в тепловом равновесии.
Обратно, можно сказать, что всякий процесс, при котором энтропия замкнутой системы тел возрастает, является необратимым. Чем больше возрастание энтропии, тем больше степень необратимости. Идеальному случаю полностью обратимого процесса соответствует случай, когда энтропия замкнутой системы оставалась бы постоянной.
Энтропия является количественной мерой степени молекулярного беспорядка в системе, т.е. степенью неопределённости системы.
1) Если число способов мало, состояние называется упорядоченным или неслучайным. Сообщение системе тепла приводит к усилению теплового движения молекул, т.е. к увеличению степени беспорядка в системе, чем выше Т (а значит, и внутренняя энергия), тем относительно меньшей оказывается доля беспорядка, обусловленного сообщением тепла 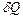 .
.
2) Если тепло 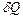 сообщается системе в ходе необратимого процесса, энтропия возрастает как вследствие сообщения тепла, так и вследствие необратимости процесса, поэтому для необратимого процесса
сообщается системе в ходе необратимого процесса, энтропия возрастает как вследствие сообщения тепла, так и вследствие необратимости процесса, поэтому для необратимого процесса 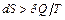 , для обратимого
, для обратимого 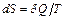 .
.
Объединяя оба выражения, получаем
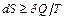 - это основное термодинамическое неравенство. Оно объединяет запись закона сохранения энергии и закона возрастания энтропии и представляет собой объединённую запись первого и второго начала термодинамики.
- это основное термодинамическое неравенство. Оно объединяет запись закона сохранения энергии и закона возрастания энтропии и представляет собой объединённую запись первого и второго начала термодинамики.
В замкнутой системе энтропия отдельного тела может уменьшаться, это не противоречит второму началу термодинамики, т.к. оно применимо лишь к замкнутым системам. При совместном рассмотрении всех частей системы полное изменение энтропии либо равно нулю, либо положительно.
Деятельность человека на земле приводит к локальному уменьшению энтропии. Холодильники и тепловые насосы способны перекачивать тепло от холодного тела к горячему. Жизнь, как биологическое явление, характеризуется процессами, уменьшающими локальную энтропию. Всюду, где наблюдается локальное возрастание упорядоченности, противостоящее беспорядку, происходит локальное убывание энтропии. Однако, полная система, включающая в себя первоисточник – Солнце, характеризуется возрастанием суммарной энтропии.
Второе начало термодинамики является фундаментальным (основным) законом физики. Однако, все фундаментальные законы (закон сохранения импульса, энергии и т.п.) были симметричны относительно обращения времени (т.е. при обращении движения всех частиц справедливы те же уравнения и законы). Второе же начало термодинамики несимметрично относительно обращения времени.
Действительно, рассмотрим систему из двух сосудов равного объёма,
1 - первый сосуд заполнен газом,
2 - второй – пустой.
Уберём перегородку, газ заполнит оба сосуда равномерно. Сколько бы мы ни ждали, обратного процесса не произойдёт.
Теперь предположим, что после заполнения газом обоих сосудов время остановилось и пошло в обратном направлении. Такую картину можно получить, если процесс заснять на киноплёнку, а потом прокрутить задом наперёд.
При этом сосуд 2 самопроизвольно пустеет и в нём возникает вакуум. Перед нами парадокс. Мы наблюдаем специфическую конфигурацию координат частиц и их скоростей в сосуде 2, которая вынуждала бы частицы двигаться и сталкиваться таким образом, чтобы все они в конечном счёте вылетали бы из сосуда 2, при этом ни один физический закон не нарушается. Парадокс устраняется тем, что кроме этой частной конфигурации частиц в сосуде 2 существует бесчисленное множество других конфигураций, при которых частицы распределены в обоих сосудах почти поровну. Поэтому на практике подобная начальная конфигурация, приводящая к вакууму в сосуде 2, хотя и допустима, но никогда не случается. Следовательно процесс расширения газа в вакуум необратим, несмотря на то, что в принципе такое «спонтанное» образование вакуума возможно.
 2015-06-28
2015-06-28 5604
5604
