Существует два основных определения кислот и оснований.
По Бренстеду[12]
кислоты – это соединения, способные к отдаче протона (доноры протонов);
основания – соединения способные принимать протоны (акцепторы протонов).
Кислотно-основное взаимодействие по Бренстеду можно изобразить следующим равновесным взаимодействием, которое приводит в образованию новых (сопряженных) кислот и оснований:
Н–А + В  А– + Н–В+
А– + Н–В+
кислота основание сопряженное сопряженная
основание кислота
По Льюису (см. сноску 2) кислоты – акцепторы электронных пар (например, трифторид бора);
основания – доноры электронных пар (например, триметиламин):
(СH3)3N: + BF3  (СH3)3N+ + –:BF3
(СH3)3N+ + –:BF3
Следует отметить, что все основания Льюиса являются основаниями Бренстеда.
Константа кислотности.
Сила кислоты в водном растворе оценивается по степени её ионизации в равновесии:
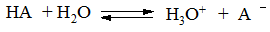
Формально константа такого равновесия следует записать как
K = [H3O+][[A–]/HA][H2O],
но так как процесс протекает в очень разбавленном растворе, концентрация воды практически постоянна ([H2O] ≈ 55 моль/л), и она входит в выражение константы кислотности К а:
К а = [H3O+][[A–]/HA],
Константа кислотности К а или более удобная величина р К а (р К а = – lg К а) и является количественной оценкой кислотности соединения. Чем ниже значение р К а, тем сильнее кислота.
Помня, что значение рН = – lg[H3O+], можно записать значение р К а:
р К а = рН + lg([HA]/[A–])
из чего следует, что в точке полунейтрализации (при [A–] = [HA]) р К а = рН.
Аналогично константу кислотности можно записать для протонизированного основания:
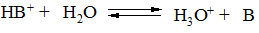
 2015-06-24
2015-06-24 3988
3988







