Введение электроноакцепторных заместителей в боковую цепь карбоновых кислот приводит к росту кислотных свойств. Например, если для уксусной кислоты СН3СООН р К а = 4.76, то для монохлоруксусной кислоты CH2ClCOOH р К а = 2.86. Напротив, электронодонорные заместители приводят к снижению кислотности. Так «метилуксусная» - пропионовая кислота СН3-СН2СООН слабее уксусной: р К а = 4.88.
А вот все орто-замещенные бензойные кислоты всегда сильнее бензойной кислоты (см. Таблицу 10).
Таблица 10
Кислотные свойства бензойной кислоты и её орто-замещенных производных
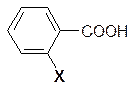
| № | Х | Название кислоты | р К а |
| Н | бензойная | 4.18 | |
| Cl | 2-хлорбензойная | 2.94 | |
| NO2 | 2-нитробензойная | 2.17 | |
| CH3 | 2-метилбензойная (орто-толуиловая) | 3.91 | |
| OH | 2-гидроксибензойная (салициловая) | 3.00 |
Одним из объяснений этого явления («орто-эффект») является проявление эффекта сопряжения в исходной бензойной кислоте. Если сравнить исходную бензойную кислоту и её моноанион, то можно отметить, что составляющие их фрагменты имеют эффекты сопряжения имеют противоположные знаки
|
|
|

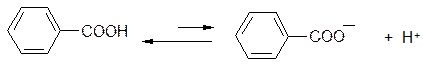
– C -эффект карбоксилат-аниона СОО– из-за наличия отрицательного заряда ниже, чем – C -эффект карбоксильной группы.
Сочетание + С -эффекта фенильного остатка с – C -эффектом кислородсодержащего фрагмента является стабилизирующим фактором.
При наличие в орто-положении заместителя из-за стерического взаимодействия нарушается копланарность системы (осуществляется поворот по связи Саром.– Скарбон.):
 |

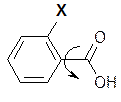
А, как известно, копланарность системы – одно из условий проявления эффекта сопряжение, который обуславливал относительную слабость бензойной кислоты. В орто-замещенных производных бензойной кислоты эффект сопряжения «не работает», следовательно эти производные более сильные кислоты, чем бензойная.
4.5 Органические основания
Электронодонорные заместители Х в основании Х–В стабилизируют образующуюся сопряженную кислоту Х–В+–Н в равновесии:



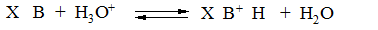
Следовательно алкиламины будут более сильными основаниями (большее значение р Ка), чем аммиак, так как алкильные группа обладают + I -эффектом и являются донорами электронной плотности. В Табл.11 приведены значения р Ка аммиака и метиламинов.
Таблица 11
Значения р Ка аммиака и метиламинов
| Формула | Название | р Ка |
| NH3 | Аммиак | 9.21 |
| CH3NH2 | Метиламин | 10.62 |
| (CH3)2NH | Диметиламин | 10.71 |
| (CH3)3N | Триметиламин | 9.80 |
Как следует из приведенных данных (см.табл.11), увеличение основности наблюдается только при переходе от первичных ко вторичным аминам. У триалкиламинов основность ниже, чем у моно- и ди-алкиламинов. Увеличение основности наблюдается в ряду:
NH3 < R3N < RNH2 < R2NH
Это объясняется тем, что образующиеся сопряженные кислоты RN+H3, R2N+H2 и R3N+H стабилизируются в воде за счет образующихся водородных связей. Такая стабилизация будет тем больше, чем больше атомов водорода.
|
|
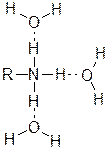
|
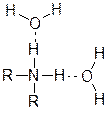
|
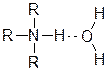
Таким образом, в алкиламинах наблюдается влияние двух противоположных факторов:
· основность повышается с увеличением числа алкильных групп за счет их + I -эффекта;
· основность уменьшается с увеличением числа алкильных групп из-за меньшей стабилизации образующихся сопряженных кислот (уменьшения числа водородных связей).
Подчеркнем, что водородные связи в данном случае возникали только в водной среде. В газовой фазе или в апротонных растворителях основность алкиламинов возрастает от первичного к третичному амину:
RNH2 < R2NH < R3N.
 2015-06-24
2015-06-24 3672
3672








