Новое направление в исследованиях контрастных веществ – молекулярная МРТ с использованием “умных агентов” – специфических молекул, позволяющих селективно метить патологические образования, определенные ткани, клетки, осуществлять направленный транспорт лекарственных веществ.
Особый интерес с целью обеспечения селективного накопления контрастных веществ в органах и повышения специфичности выявления заболеваний представляют оксиды железа и липосомы.
Частицы оксида железа посредством фагоцитоза захватываются клетками ретикулоэндотелиальной системы. Тем самым создается возможность селективного контрастирования печени, селезенки, лимфатических узлов и костного мозга. Кроме того, оксиды железа применимы для контрастирования рецепторов и антител, а также для исследования кровоснабжения сердца и головного мозга. В зависимости от размера, состава, концентрации, насыщения намагниченностью исследуемой области оксиды железа могут быть как позитивными, так и негативными контрастными агентами. Их распределение по тканям определяется размером, формой, зарядом, гидрофильностью или гидрофобностью, химическим составом и оболочкой.
Большинство веществ имеет полидисперсную (больше одной группы кристаллов оксида железа разного размера) или поликристаллическую (каждая частица содержит множество кристаллов) структуру. Оксиды железа, выпускаемые для активного накопления, имеют монодисперсную (группа кристаллов одного размера) и монокристаллическую (каждая частица содержит только один кристалл) структуру. В них желательно добавлять более мелкие суперпарамагнитные метки.
Еще один вид контрастных веществ, выпускаемых в виде частиц, − липосомы. Парамагнитный ион можно инкапсулировать в водную часть или присоединить к липидному бислою. Клинические испытания прошли липосомы как с хелатами гадолиния, так и марганца. В настоящее время предлагают использовать липосомы, имеющие более сложное строение, − к примеру, фосфолипидные спин-меченые и амфипатические хелатные комплексы.
Кроме сосудистых структур, можно добиться контрастирования гепатоцитов или клеток ретикулоэндотелиальной системы. Сосудистые структуры и сильно васкуляризированные образования как правило контрастируют при динамических исследованиях посредством стандартных низкомолекулярных контрастных веществ на основе комплексов Gd или Mn.
Частицы оксида железа и липосомы избирательно захватываются ретикулоэндотелиальной системой [60,61]. Частицы оксида железа могут влиять и на время T 1-релаксации, и на отношение T 2/ 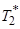 . Частицы оксида железа, которые вводятся внутривенно, должны иметь размер менее 50 нм в диаметре, чтобы не захватываться при прохождении через легкие. Такие частицы получили название SPIO (суперпарамагнитрые частицы железа) и USPIO (ультрамелкие суперпарамагнитрые частицы железа).
. Частицы оксида железа, которые вводятся внутривенно, должны иметь размер менее 50 нм в диаметре, чтобы не захватываться при прохождении через легкие. Такие частицы получили название SPIO (суперпарамагнитрые частицы железа) и USPIO (ультрамелкие суперпарамагнитрые частицы железа).
Контрастные вещества, которые связываются со специфическими рецепторами, могут позволить дифференцировать злокачественные опухоли печени (такие, например, как печеночно-клеточный рак) от доброкачественных новообразований (таких, к примеру, как фокальная узловая гиперплазия или аденома).
При исследовании печени может быть использована еще одна группа контрастных веществ − липосомы, содержащие хелаты гадолиния [62, 63]. Эти вещества обеспечивают продолжительное усиление контраста сосудистых структур, печени и селезенки.
Накапливающиеся в печени вещества усиливают интенсивность сигнала и от селезенки. Частицы оксида железа улучшают выявление метастазов в селезенке, а также позволяют дифференцировать доброкачественную и злокачественную спленомегалию (например, при лимфоме или лейкозе).
В клинической практике пока еще не используются специфические контрастные агенты, накапливающиеся в лимфатических узлах. В такой области научных исследований, как МР-лимфография, также весьма перспективным являетсяся применение частиц оксида железа. Покрытые оболочкой из декстрана, такие частицы доставляются к лимфатическим узлам.
Одна из наиболее важных задач разработки контрастных веществ – усиление сигнала от опухолей. Развитие оборудования и программного обеспечения должно позволить проводить быстрые скрининговые исследования для выявления рака, включающие проведение быстрого МР-исследования всего тела с введением специфических контрастных веществ, избирательно накапливающихся в опухолях.
Металлопорфирины – соединения, специфически аккумулируемые различными опухолями [64]. В качестве контрастных веществ, специфичных для опухолей, могут быть использованы растворимые в воде порфирины, меченые марганцем.
Неспецифическое увеличение интенсивности сигнала от опухолей в раннюю фазу и резко выраженное усиление сигнала от очагов некроза в позднюю фазу контрастирования показало использование гадолиний-мезапорфирина и марганец-тетрафенилпорфирина. Это открытие может выявить новые области применения этих веществ, например, для определения очертаний области инфаркта миокарда или мониторинга противоопухолевой терапии [65].
Кроме того, синтезированы специфичные для опухоли моноклональные антитела, меченые гадолинием или наночастицами оксида железа. Исследования на животных показали, что такие контрастные вещества усиливают сигнал от специфичных опухолей и мест, содержащих антигены (например, при инфаркте миокарда или инфекционных заболеваниях) [66, 67].
Не прекращается разработка новых контрастных препаратов для МРТ. Создание низкоосмолярных МР-контрастных препаратов позволяет при необходимости увеличивать их дозировку, что может быть полезным для выявления новых зон поражения мозга при рассеянном склерозе и метастазах опухолей, а также для более четкого определения границ ряда внутримозговых опухолей. Помимо создания препаратов для введения в кровь, разрабатываются новые способы инфузионного контрастирования полых органов и дыхательной системы. Весьма перспективен в данном направлении метод визуализации легких, основанный на вдыхании изотопов инертных газов с гиперполяризованными ядрами (предложены к применению гелий 3He и ксенон 129Xe). Данная технология еще недоступна для клинического применения в связи со значительными техническими трудностями ее проведения, но она открывает перспективы использования МРТ для диагностики заболеваний легких, которые обычно считаются органом, недоступным для МРТ исследования.
Можно полагать, что в ближайшие годы будут разработаны и другие, возможно, принципиально новые подходы к повышению диагностической эффективности МР методов исследования.
 2015-06-28
2015-06-28 663
663








