В большинстве случаев МР томограф настроен на получение изображений от протонов водорода, находящихся в теле пациента. Контраст в МРТ является результатом различия в сигнале от смежных пикселей или вокселей, сигнал в наибольшей степени зависит от трех основных параметров: протонной плотности, времени спин-решеточной релаксации T1, и времени спин-спиновой релаксации T2. Плотность спинов, пропорциональная суммарной намагниченности спиновой системы M0, отражает общее количество спинов, доступных для получения МР-изображения в пределах данной ткани (или пикселя).
Времена релаксации T1 и T2 описывают законы, по которым изменяется спиновая система. T1 - закон, по которому система возвращается к равновесию после возбуждения энергией РЧ поля. Чем быстрее система возвращается к равновесию, тем больше доступных спинов для возбуждения следующим импульсом.
Спин-спиновая T2 -релаксация описывает процесс расфазировки МР-сигнала из-за локальной неоднородности магнитного поля, возникающей за счет взаимодействия спинов друг с другом, в результате чего происходит потеря интенсивности МР-сигнала. В общем случае расфазировка спиновых прецессий ядерных моментов вызывается не только спин-спиновыми взаимодействиями, но и и наличием неоднородных локальных внешних магнитных полей в объеме образца, обусловленных или неоднородностью постоянного магнитного поля B0, или градиентными магнитными полями, создаваемыми соседними магнитными моментами других ядер и неспаренных электронов. В этом случае говорят о времени поперечной релаксации T2*:
1/ T2* = 1/ T2 + γδ B /π, (67)
где γ – гиромагнитное отношение, δ B – неоднородность локального магнитного поля.
Времена T1 и T2 зависят от нескольких параметров [42]:- резонансной частоты (индукции магнитного поля);- температуры; - подвижности спинов (микровязкости); присутствия больших молекул; - присутствия парамагнитных молекул.
Контраст МР-изображений зависит в большей или меньшей степени от T1, T2 или T2* и протонной плотности. Таблица 3 [43] показывает времена релаксации различных тканей в магнитном поле 1.5 Tл и температуре 37°C. Хороший контраст мягких тканей на МР-томограммах (рис. 20) обусловлен в основном различными временами релаксации, как в случае МР-изображений тканей головного мозга, на которых можно легко различить серое и белое вещество.
Таблица 3. Типичные времена релаксаций различных тканей в магнитном поле 1.5 Tл и температуре 37°C. R1=1/T1, R2=1/T2 – скорости релаксации([43]).
| Ткань | Т1, мс | R1, с-1 | Т2, мс | R2, с-1 |
| серое вещество | 1,05 | |||
| белое вещество | 1,67 | 12,5 | ||
| мышечная ткань | 1,11 | |||
| спинномозговая жидкость (СМЖ) | 0,22 | 0,45 | ||
| жир | 4,00 | 16,67 | ||
| кровь | 0,83 | 100-200 | 5-10 |
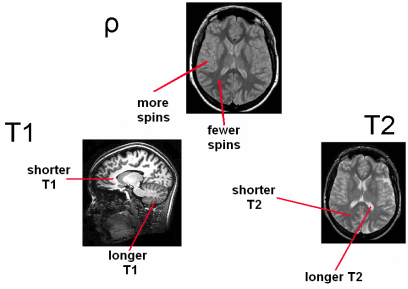
Рис. 20. Примеры МР-изображений [43].
На изображениях взвешенных по протонной плотности более яркие пиксели соответствуют более высокой плотности спинов. Параметр T1 влияет на контраст в белом и сером веществе (см. времена T1 в таблице 3), на Т1 -взвешенном изображении белое вещество с более коротким T1 кажется более ярким. Из-за длинного T2 спинномозговая жидкость выглядит яркой на Т2 -взвешенном изображении.
Так как T1 и T2 являются основными параметрами контраста МР-изображений, именно эти параметры должны быть изменены любым потенциальным контрастным агентом. Самыми распространенными МР контрастными агентами являются парамагнитные комплексы ионы гадолиния и суперпарамагнитные частицы оксида железа (см. Таблицу 4). Гадолиниевые контрастные агенты используются прежде всего для сокращения времени спин-решеточной Т1 релаксации, хотя при высоких концентрациях они могут оказывать существенное влияние и на T2 релаксацию. Контрастные агенты на основе оксида железа, с другой стороны, оказывают меньшее влияние на T1 и используются, прежде всего, для сокращения T2 *.
Таблица 4: Значения релаксационной эффективности основных контрастных агентов [44].
| МР контрастный агент | Главное использования | Молекулярная масса или размер частицы | Релаксивность, (мМ л)-1 | Назначение (цель) |
| Gd-DTPA | Т1-агент | 0,6 кДа | r1 = 3,7 | Внеклеточный |
| Dextran-Gd-DTPA | Т1-агент | 75 кДа | r1 = 11 | Кровь (Blood-pool) |
| Carboxydextran-coated SPIO SHU-555 | Т2-агент | 62 нм | r1 = 12 r2 = 188 (0,94T) | Капиллярная проходимость |
| Dextran-coated SPIO AMI-25 | Т2-агент | 58 нм | r1 = 24 r2 = 107 (0,47T) | Органы MPS (печень) |
| Dextran-coated USPIO MION-46L | Т2-агент | 18-24 нм (CLIO 30 -40 нм) | r1= 16 r2= 35 (0,47T) | Органы MPS |
| Dextran-coated USPIO AMI-227 | Т2-агент | 17 -20 нм | r1 = 23 r2 = 53 (0,47T) | Узлы лимфы |
| MION-encapsulated liposomes (MION-скрытые липосомы) | Т2-агент | 170 - 300 нм | r1 = 23 r2 = 130 (0,47T) | Органы MPS (печень) |
| PEGylated magnetoliposomes | Т2-агент | 40 нм | r1 = 3 r2 = 240 (1,5T) | Костный мозг |
| (Protein-coated) magnetoferritin | Т2-агент | 12 нм | r1 = 8 r2 = 218 (1,5T) | Кровь (Blood-pool) |
Связь спинов протонов с большими магнитными моментами суперпарамагнитных веществ увеличивает релаксивность воды, делая их полезными в качестве контрастных агентов для МРТ. В присутствии суперпарамагнитных веществ, таких как наночастицы оксида железа, времена релаксации ядерных спинов протонов воды, T1, T2 и T2 *, сокращаются [43]. Что касается T2 и T2 *, магнитные наночастицы действуют как магнитные моменты, производящие крошечные градиенты локального магнитного поля, через которые протоны осуществляют диффузию. Так как каждый протон будет иметь отдельный путь через градиентное поле, то разности фаз между протонами будут накапливаться. В результате будет происходить индуцированная различной восприимчивостью расфазировка МР сигнала протона с последующим уменьшением Т2 *. Это сокращение T2 * может быть использовано в МРТ-эксперименте, когда наночастицы сильно намагничены.
При использовании суперпарамагнитных частиц оксида железа релаксация вызвана время- или частотно-модулированными взаимодействиями между протонами и магнитными моментами частиц [44]. Связь может быть дипольного и скалярного характера, а временная или частотная модуляция возникает из-за трансляционной диффузии протонов, вращательной диффузии магнитных частиц и обмена между связанными протонами биомакромолекул и протонами свободной воды.
В настоящее время, теория, объясняющая сокращение T2* протонов воды парамагнитными ионами магнитных наночастиц может быть разделена на две группы: модели внутренней сферы (IS) и внешней сферы (OS) [45]. Теория внутренней сферы рассматривает обмен между координированными молекулами воды и молекулами объемной воды. Теория внешней сферы описывает релаксацию индуцированную диффузией молекул воды в пределах градиентного магнитного поля вокруг парамагнитного гидратированного иона. IS вклад состоит из протонов, физически взаимодействующих с парамагнитным ионом. В этом случае расстояние между ионом и координированной молекулой воды в среднем меньше, чем между гидратированным ионом и диффундирующей молекулой воды в модели OS. Кроме того, координированные протоны находятся на местах связывания дольше, подвергаясь воздействию магнитных ионов в течение более длительного времени, чем в случае диффундирования протона в модели OS. Как результат, вклад IS, как правило, больше, чем вклад OS. Однако, для хелатных ионов и в отсутствие обмена протонов воды, механизм OS доминирует в релаксации.
Релаксацию, индуцируемую частицами магнетита (Fe3O4) в целом можно отнести к диффузии молекул воды вокруг суперпарамагнитного ядра железа. Она может быть в целом описываться теорией OS, адаптированной для учета анизотропии кристаллов магнетита [46]. Применение IS в сравнении с теорий OS может математически определяться критерием τD Δ ωr, где τD = r 2 / D (г - радиус частиц, D является коэффициентом диффузии воды, и Δ ωr является среднеквадратическим сдвигом угловой частоты на поверхности частиц). Для τD Δ ωr <1 выполняется режим усреднения движения. Скорость релаксации тогда задается квантово-механической теорией внешней сферы:
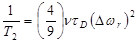 (68)
(68)
где v является частью объема занимаемой наночастицами. Для τD Δ ωr > 1 работает режим статической расфазировки. Этот термин относится к расфазировке неподвижных магнитных моментов, но также остается справедливым и для медленного движения, где расфазировка проявляется в одиночном столкновении протона и сдвиг поля составляет больше, чем один радиан. В этом случае скорость релаксации для сферических частиц характеризуется уравнением:
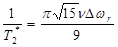 , (69)
, (69)
где Δ ωr определяется по формуле:
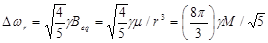 , (70)
, (70)
где γ - протонное гиромагнитное отношение, Beq - экваториальное магнитное поле частицы, μ - магнитный момент, и М - ее намагниченность.
В случае синтезированных наночастиц оксида железа, вполне вероятно, что комбинирование процессов происходит в процессе расфазировки. В хорошо-дисперсном растворе, протоны будут диффундировать через магнитные градиенты, накапливая фазу Δ ω = γ Δ B, где Δ В –градиентное магнитное поле частицы, воздействующее на протон. Однако, на границе между частицей и протонами воды, вполне вероятно, существуют несколько типов событий. Протоны могут физически обмениваться с протонами в молекулах, составляющих оболочку (покрытие) частиц. Такие взаимодействия, как правило, известны как химический обмен и были использованы для MTC- томографии (контрастирование с использованием переноса намагниченности) [47, 48] и в развитии класса соединений, известных как агенты переноса насыщения, зависящего от химического обмена (CEST) [49].
Не исключено, однако, что оболочка молекулы может влиять на протоны иными способами, чем прямой химический обмен. Диффузия протона может быть замедлена в областях вблизи частиц за счет молекулярных сил, а в некоторых случаях, таких, как фосфолипид-полиэтилен-гликолевая (PEG) оболочка частицы, не исключено, что протоны могут диффундировать в и из пространства между оболочками молекул [50] (рис. 21). В результате может происходить эффективное изменение в диффузии протонов вокруг частиц, которое приводит к изменению релаксационных характеристик наночастиц, основанных на специфических свойствах оболочки.
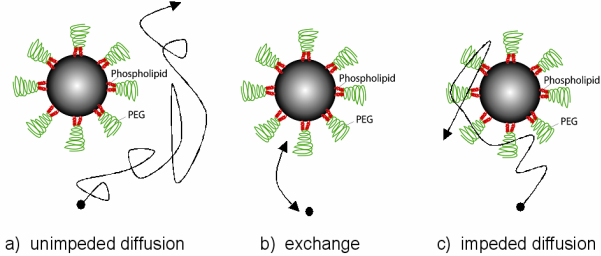
Рисунок 21 Различные схемы диффузии протонов и взаимодействия с наночастицами и их оболочкой. a) диффузия протонов мимо наночастицы представляет основной вклад в теорию внешней сферы (OS), b) диффундирующие протоны воды могут обмениваться с протонами на поверхности частиц; увеличение времени пребывания и сближение вплотную приводит к эффекту во внутренней сфере (IS), c) диффузия может быть ограничена оболочкой частиц, приводя к случаю где-то между OS и IS.
Существующие теории сосредотачивают внимание или на диффузии протонов мимо наночастиц или на химическом обмене в качестве механизмов для релаксации. Взаимодействие между протонами и оболочкой наночастицы хотя и не до конца понятно, но, однако, может иметь значительное влияние на индуцированную релаксацию. Такие взаимодействия не в полной мере учитываются в современных теориях, и дальнейшее более глубокое понимание такого влияния может помочь в разработке более эффективных контрастирующих агентов-зондов. Это особенно важно в томографии in vivo, когда важно обеспечить малый размер зонда и усилить релаксационные характеристики.
Есть много факторов, которые потенциально могут повлиять на способность магнитных наночастиц индуцировать уменьшение T2 *. К ним относятся физические размеры частицы и ее оболочки, химические свойства оболочки и окружающей среды, движение частиц и протонов, и неоднородности в самих частицах. Регулируя размер ядра, толщину оболочки, химию поверхности, и нацеленные на мишень лиганды, зонды наночастиц могут быть ориентированы, чтобы достигать конкретные мишени в виде определенных органов, клеток, или даже молекулярных маркеров различных заболеваний in vivo [51]. Релаксация магнитных наночастиц, как правило, модулируется размером ядра, часто в диапазоне 4-20 нм в диаметре. Однако, меньше известно о влиянии свойств оболочки на индуцированную наночастицами релаксацию. Поскольку многие из этих факторов могут взаимодействовать сложным образом, влияя на релаксацию, то выяснение влияния свойств оболочки на уменьшение Т2 * может обеспечить полезную основу для разработки более мощных зондов-наночастиц без необходимости увеличения размера зонда.
Для сферической частицы определенного размера ядра, можно представить себе силовые линии магнитного поля, распределенными в пространстве в соответствии с уравнением для диполя [50] (рис. 22а).
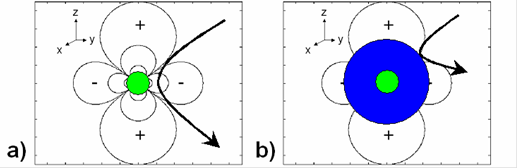
Рисунок 22 Оболочка частицы предотвращает приближение протонов к магнитному ядру. а) Протоны диффундируют через дипольное поле наночастицы (окрашенной в зеленый цвет). b) В связи с большой оболочкой (синий цвет), протоны не могут получить доступ к пространству вблизи частицы, где градиенты поля являются наибольшими.
Здесь мы касаемся только Z -компоненты магнитного поля. Магнитные наночастицы вызывают релаксацию Т2 * протонов, проходящих через эти градиентные поля наночастиц. Протоны индивидуально накапливают изменения фазы в соответствии с Δ φ = γ · Bz · Δ t, где Δ t – промежуток времени, в течение которого протон находится в градиентном поле. Поскольку протоны находятся первоначально в фазе, то спад сигнала, из-за расфазировки, происходит из-за градиентного поля частицы, а не от основного магнитного поля. На рисунке 22а, ядро частицы (зеленое) производит определенное магнитное поле, через которое частицы могут диффундировать. На рисунке 22b, то же самое ядро окружено оболочкой, которое физически исключает диффузию протонов из некоторой области вокруг ядра. Хотя ядро производит то же поле, протоны имеют меньший доступ к более высоким градиентам вблизи частицы. Как результат, предполагается, что протонная релаксация в ситуации частицы с оболочкой будет медленнее, что приводит к наблюдаемому уменьшению R2 с ростом размера оболочки.
Таким образом, результаты исследований могут привести к пониманию взаимосвязи между размерами оболочки и изменениями релаксации, и соответственно, к разработке оптимальных магнитных наночастиц – зондов для молекулярной МРТ.
Суперпарамагнитные наночастицы оксида железа все чаще используются в разработке зондов МРТ из-за их влияния на релаксивность [51]. Эти наночастицы уже сейчас играют растущую роль в отслеживании стволовых клеток [52], в сортировке клеток и ДНК [53] и в доставке лекарств [54].
Особый интерес представляют исследования возможностей использования суперпарамагнитных наночастиц оксида железа в низкопольной МР-томографии.
2. ИССЛЕДОВАНИЯ ЯМР СПЕКТРАЛЬНЫХ И РЕЛАКСАЦИОННЫХ ХАРАКТЕРИСТИК СУПЕРПАРАМАГНИТНЫХ СУСПЕНЗИЙ НАНОЧАСТИЦ В ВОДНЫХ РАСТВОРАХ И БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ
Цель исследований: исследования концентрационных эффектов влияния суперпарамагнитных наночастиц оксида железа на форму линии ЯМР и времена релаксации Т1, Т2 протонов воды с учетом вкладов диффузионного обмена в неоднородное уширение линии ЯМР.
Объекты исследований: суперпарамагнитные наночастицы оксида железа в водных суспензиях, суперпарамагнитные наночастицы оксида железа в составе пористых микросфер целлюлозы.
Исследуемые параметры: ширина линии ЯМР протонов воды, химический сдвиг протонов воды и времена протонной релаксации Т1, Т2.
Методы определения: измерение спектров ЯМР методом ЯМР фурье-спектроскопии, измерение времени спин-решеточной релаксации Т1 методом инверсии намагниченности, измерение времени спин-спиновой релаксации методом спинового эха.
Приборные средства измерений: Фурье спектрометр ядерного магнитного резонанса СХР-300 (Брукер, Германия) с величиной магнитного поля 7,1 Т. Все измерения осуществлялись в стандартных стеклянных ампулах диаметром 5 мм без вращения. Для стабилизации поля использовали сигнал дейтериевого резонанса тяжелой воды, которая добавлялась в количестве 50 мкл к 500 мкл суспензий магнитных наночастиц.
Параметры импульсных последовательностей
Для получения 1Н ЯМР спектров использовалась одноимпульсная последовательность (длительность 90° импульса 0,5 мкс; длительность паузы между 90° импульсами 3 с; количество повторений 4).
Для измерения времени Т1 использовалась импульсная последовательность «инверсия-восстановление»180°-t-90° (длительность 90° импульса 4,4 мкс; длительность 180° импульса 8,8 мкс; длительность пауз между 180° и 90° импульсами: 1 мкс, 10 мкс, 100 мкс, 1 мс, 10 мс, 100 мс, 1с, 10 с, всего 8 точек; длительность паузы между 180° импульсами 10 с).
.Для измерения времени спин-спиновой релаксации Т2 применяли последовательность импульсов Carr-Purcell-Meilboom-Gill (длительность 90° импульса 4,4 мкс; длительность 180° импульса 8,8 мкс; время эхо от 1 мкс до 7 мс для разных образцов; 32 сигнала эхо).
Постановка задачи.
Избирательное введение в ткани органов пара, ферри и ферромагнитных веществ является одним из путей повышения информативности метода МРТ. МР-контрастные вещества вызывают усиление или ослабление сигнала ядерного магнитного резонанса, тем самым увеличивая контраст изображений органов. Мировой фармацевтический рынок диагностических МР-контрастных препаратов представлен двумя главными группами МР-позитивных и МР-негативных контрастных препаратов. МР-позитивные контрастные препараты вызывают повышение яркости мест локализации, что способствует улучшению видимости контура органа или мест патогенеза. Для избирательного контрастирования и визуализации канцерогенеза более предпочтительны ферро- и ферри- контрастные препараты негативного принципа действия, которые в отличие от экстрацеллюлярных комплексов гадолиния (позитивный контрастер) способны включаться в клетки по механизму эндоцитоза. Особый интерес представляют ферримагнетики оксида железа, которые способны образовывать наноразмерные частицы с суперпарамагнитными свойствами. Входя в состав МР-негативных контрастирующих препаратов, такие суперпарамагнитные наночастицы придают ему высокие значения магнитной восприимчивости. Среди МР – негативных контрастеров нанодисперсные препараты оксида железа занимают особое доминирующее положение. Для придания биосоместимости и повышения стабильности коллоидных суспензий частицы оксида железа покрывают гидрофильным слоем полимера или ионов органических молекул. В таком виде наночастицы оксидов железа сохраняют магнетизм, имеют малую токсичность и могут применяться в высоких дозах при диагностических обследованиях печени, селезенки, лимфатической системы и желудочно-кишечного тракта.
При неспецифическом поглощении наночастиц клетками ретикуло-эндотелиальной системы они индуцируют в ближайшей окрестности клетки сильное магнитное поле, которое визуализируется как затемнение визуального поля в методе МРТ. Уменьшение яркости зоны наблюдения связано с так называемым эффектом сокращения времени спин-спиновой релаксации Т2 протонов молекул окружения, поэтому такие МР- препараты также называют Т2 – контрастерами. Эффективность контрастирующего действия суперпарамагнитных частиц зависит от степени экранирования магнитных центров при включении в макрофагальные клетки, моноциты, которое приводит с одной стороны к увеличению удельной намагниченности этих клеток за счет концентрирования магнитного материала, а с другой – к уменьшению содержания магнитных частиц во внеклеточной среде (плазме). Это приводит к сильному перераспределению магнитной плотности по тканям и как следствие к артефактным эффектам при исследованиях МРТ. Высокая интенсивность движения молекул воды возле магнитных наночастиц вызывает заметное ослабление измеряемого сигнала ЯМР в области вокселя анализируемой области, что в результате дает усиление контраста изображения. Необходимо ясно представлять роль экранирующего воздействия стенок клеток в трансмембранном транспорте воды на контрастирующие свойства препарата. Учет влияния диффузионного обмена имеет еще одно значение: нахождение магнитных наночастиц в ферментативно активной жидкой среде организма ведет к сокращению срока жизни магнитного состояния частицы. Включение магнитной частицы внутрь защитной оболочки увеличивает время жизни контрастера при парентеральном введении, но одновременно снижает фактор неоднородности магнитного поля за пределами зоны нахождения частицы в капсуле.
Для оценки фактора диффузионного обмена воды при включении магнитных наночастиц в клетки ретикуло-эндотелиальной системы рассмотрена модель микроносителя с внедренными магнитными наночастицами и регулирумой скоростью диффузионного обмена воды, которая отражает основные закономерности магнитной релаксации в биологических жидкостях. Исследование строилось путем сравнения скорости магнитной релаксации в суспензии суперпарамагнитных наночастиц оксида железа в воде и суспензии микросферических носителей.
Содержание работы:
1. Синтез суперпарамагнитных наночастиц оксида железа в гетерофазных условиях из растворов двух и трехвалентного железа по схеме Элмора-Массарта.
2. Включение суперпарамагнитных наночастиц оксида железа в поры микросферической матрицы целлюлозы.
3. Измерение спектров ЯМР водных суспензий магнитных наночастиц оксида железа в воде и плазме крови.
4. Измерение скорости ядерной магнитной релаксации протонов воды в суспензиях магнитных наночастиц в воде и плазме крови.
Экспериментальные результаты исследований.
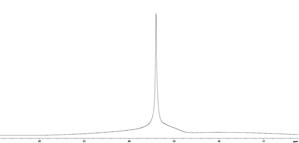
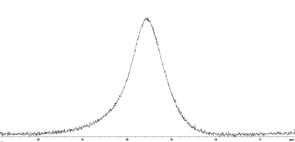
Полученные спектры ЯМР протонов дистиллированной воды и плазмы крови до- и после введения МР-контрастирующих веществ на основе наночастиц оксида железа (концентрация наночастиц Fe3+ составляла 1,8 мМ/л) (рис. 41) показывают, что сигналы ЯМР протонов воды и плазмы крови по форме до- и после введения контрастного вещества практически идентичны, наблюдается значительное уширение сигналов ЯМР как протонов воды, так и плазмы крови после введения контрастного вещества. До введения контрастера ширина линии составляла примерно 0,05 м.д., а после введения линия уширилась до 1 м.д.
Результаты измерений скорости ядерной магнитной релаксации протонов воды в суспензиях магнитных наночастиц в воде и плазме крови представлены в Таблице 5.
 |  |
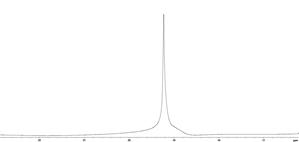 | 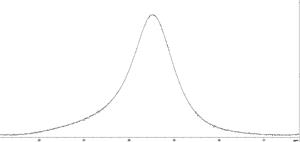 |
Рис. 41. Спектры ЯМР протонов дистиллированной воды (сверху) и протонов плазмы крови (снизу) до- (слева) и после (справа) введения МР-контрастирующих веществ на основе наночастиц оксида железа.
Таблица 5. Скорости ядерной магнитной релаксации протонов воды в суспензиях магнитных наночастиц в воде и плазме крови
| Скорости ядерной магнитной релаксации | R2*, л/мМ с | R2, л/мМ с | R1, л/мМ с |
| Контрастный агент в воде | 382±17 | 187±27 | 1,6±0,1 |
| Контрастный агент в плазме крови | 112±5 | 164±25 | 1,5± 0,1 |
По результатам измерений были получены зависимости скоростей ядерной магнитной релаксации протонов воды от концентрации контрастирующего вещества в суспензиях наночастиц оксида железа в воде и плазме крови (рис. 42-47).
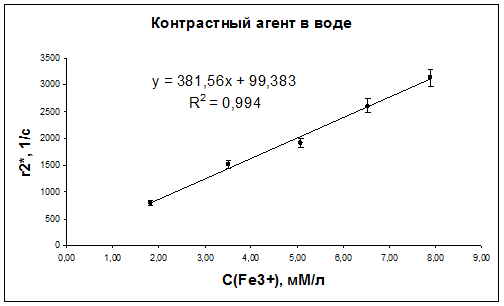
Рис. 42. Зависимость скорости релаксации r2* протонов дистиллированной воды от концентрации наночастиц оксида железа.
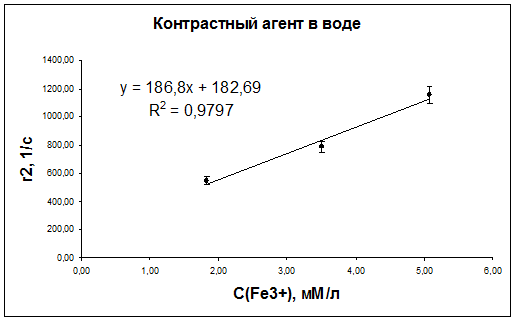
Рис. 43. Зависимость скорости релаксации r2 протонов дистиллированной воды от концентрации наночастиц оксида железа.
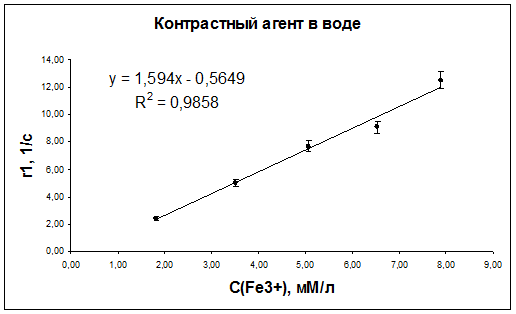
Рис. 44. Зависимость скорости релаксации r1 протонов дистиллированной воды от концентрации наночастиц оксида железа.
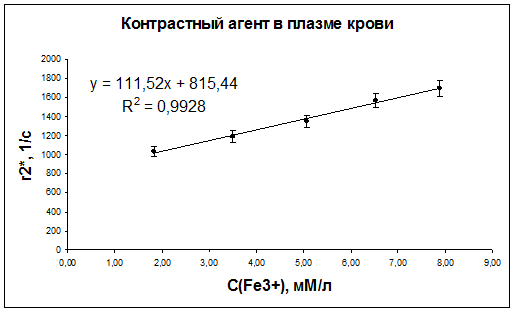
Рис. 45. Зависимость скорости релаксации r2* протонов воды плазмы крови мышей от концентрации наночастиц оксида железа.
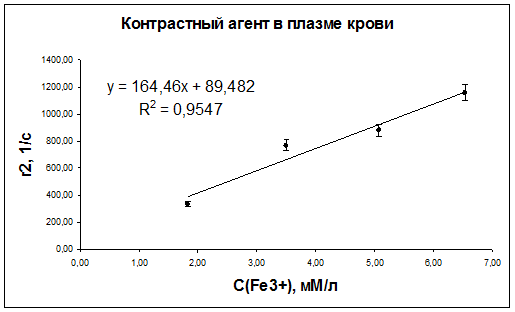
Рис. 46. Зависимость скорости релаксации r2 протонов воды плазмы крови мышей от концентрации наночастиц оксида железа.
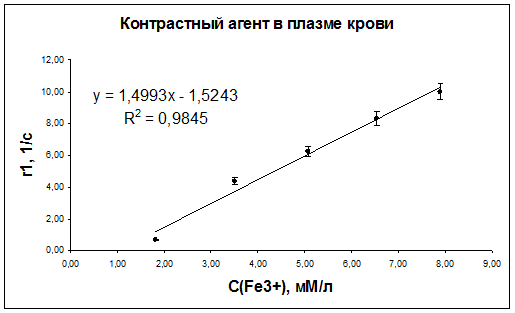
Рис. 47. Зависимость скорости релаксации r1 протонов воды плазмы крови мышей от концентрации наночастиц оксида железа.
В результате исследования релаксационного поведения протонов воды в водных суспензиях магнитных наночастиц оксида железа и плазме крови установлено, что присутствие сывороточных белков в плазме уменьшает эффект неоднородного уширения линии ЯМР за счет экранирования ядра магнитных частиц адсорбционным слоем белков. Как видно из таблицы 5 этот эффект проявляется в трехкратном сокращении скорости ядерной магнитной релаксации R2* и практически не сказывается на скорости спин-решеточной релаксации. Образование адсорбционного слоя белков ведет к опсонизации частиц контрастера и усилению макрофагального захвата в процессе эндоцитоза, которое является вторым источником экранирования магнитных центров. Моделирование эффектов неоднородного уширения линии путем искусственного экранирования магнитных наночастиц оксида железа полупроницаемой матрицей целлюлозы подтвердило справедливость этих заключений.
Магнитные наночастицы оксида железа были введены в матрицу целлюлозы in situ. Получение микросферического пористого носителя суперпарамагнитных наночастиц осуществлялось следующим образом. В реактор ёмкостью 200 мл. помещали суспензию микросферической целлюлозыс с диаметром 80 -120 мкм.. При постоянном перемешивании и температуре насыщали поры микросфер смесью растворов солей железа в течение определённого времени. После пропитки капиллярных пор в реакционную массу добавляли раствор щелочи и выдерживали при постоянном перемешивании и температуре согласно условиям опыта. Наночастицы магнетита формировались внутри пор в соответствии с реакцией
2FeCl3×6H2O + FeSO4×7H2O + 8NH4OH→Fe3O4↓ + 6NH4Cl + (NH4)2SO4 + 23H2O
Fe2+ + Fe3+ + 8OH- ↔ Fe3O4↓ + 4H2O
Композит микросферической целлюлозы, содержащий магнитные частицы, промывали деконтацией дистиллированной водой до нейтрального значения рН. В полученных образцах была измерена концентрация ионов железа. Измерение спектров ЯМР суспензий магнитных наночастиц, включенных в микросферический носитель целлюлозы (рис.48 и 49) показало значительное уширение линии резонанса внутренней воды.
Существование сложной капиллярной системы узких пор в микросфере препятствовало свободному диффузионному обмену внешней воды с внутренней, что отразилось в ее меньшей ширине линии внешней межчастичной воды. Уширение линии ЯМР, вызванное частицами магнетита 100 ррм, заметно превышает величину уширения, вызываемого парамагнитными ионами трехвалентного железа 17 ррм. и магнитными частицами в водных суспензиях. Положение центра линии резонанса протонов воды в суспензии в целом совпадает с положением линии резонанса объемной фазы воды 4,8 ррм..
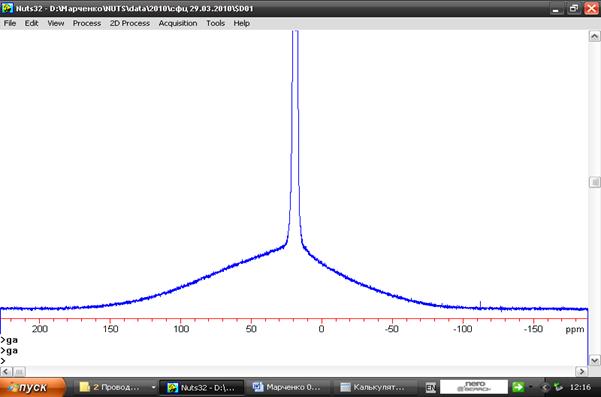
Рис.48. Спектр протонного резонанса воды в суспензии суперпарамагнитных наночастиц оксида железа, осажденных в порах микросферической целлюлозы диаметром 80-120 мкм. Полуширина линии внутренней воды 100 ppm, внешней 0,67 ppm.
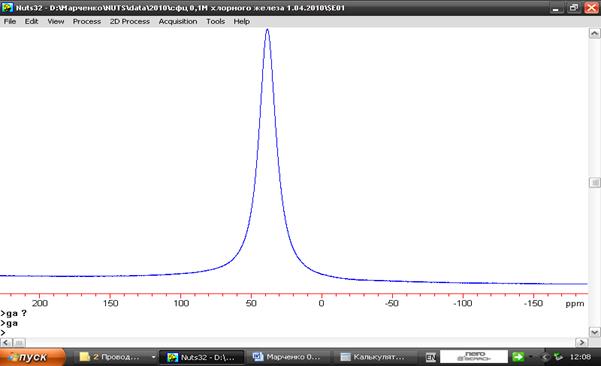
Рис.49. Спектр протонного резонанса 0,1М раствора FeCl3, сорбированного микросферической пористой целлюлозой. Полуширина линии воды 17 ppm.
Анализ формы линии ЯМР суспензии микросфер (рис.50) показал, что форма линии лучше описывается функцией Лоренца, чем гауссовой функцией распределения.
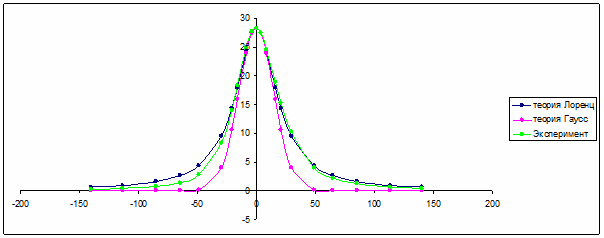
Рис.50. Сравнительный анализ формы линии резонанса протонов сорбированной воды в суспензии микросферической целлюлозы. Фракция частиц диаметром 125-80 мкм в CCl4.
Этот результат отличается от теоретических выводов по оценке неоднородного уширения линии в суспензии магнитных частиц в пренебрежении межчастичных магнитных взаимодействий [76, 77]. Искажение магнитного поля, индуцируемое полями магнитных наночастиц должно приводить к гауссовому типу распределения частоты резонанса. Диффузионный обмен воды в порах микросферического носителя сглаживает неоднородности поля за времена прецессии спинов (около нескольких мкс), что и приводит к изменению типа формы линии и моноэкспоненциальному спаду сигнала магнитной прецессии. Таким образом, включение суперпарамагнитных наночастиц в микросферический носитель сохраняет контрастирующие свойства магнитных наночастиц, одновременно защищая микрокристаллы магнетита от действия агрессивных факторов биологических жидкостей внутренней среды организма. Сокращение времени спин-спиновой релаксации суспензии магнитных носителей, оцененное по ширине линии, не уступает величине скорости релаксации суспензии суперпарамагнитных наночастиц непосредственно в водном растворе. Следовательно, контрастирующие свойства суспензии суперпарамагнитных наночастиц, включенных в состав микросфер целлюлозы, сохраняются на уровне первоначального источника - суспензии наночастиц оксида железа в воде. Моделирование макрофагальных клеток микросферами с ограниченным диффузионным транспортом воды через поверхность сфер показало, что контрастирующие свойства магнитных наночастиц не должны утрачиваться при макрофагальном эндоцитозе магнитных наночастиц.
Выводы:
1. Показано, что контрастирующая эффективность магнитных наночастиц при включении в микросферический носитель из целлюлозы не утрачивается по сравнении c суспензией магнитных наночастиц непосредственно в водной среде.
2. Ограниченный диффузионный обмен между капиллярной внутренней водой и внешней объемной фазой способствует сокращению времени спин-спиновой релаксации, и тем самым уширению линии ЯМР, что является ведущей причиной контрастирующей эффективности магнитных наночастиц магнетита.
3. Релаксационная эффективность магнитных наночастиц оксида железа в плазме крови падает из-за экранирующего воздействии адсорбционного слоя сывороточных белков вокруг частиц.
Исследования ЯМР контрастирующих свойств нанодисперсных частиц оксида железа в зависимости от их концентрации, размера, формы, заряда, химического состава и гидрофильных (гидрофобных) свойств оболочки
 2015-06-28
2015-06-28 1903
1903








