Цель исследований: исследования спектров ЭПР суперпарамагнитных наночастиц оксида железа в водных растворах в зависимости от их размера и концентрации
Объекты исследований: суперпарамагнитные наночастицы оксида железа в дистиллированной воде и водных физиологических растворах.
Исследуемые параметры: ширина и форма линий ЭПР наночастиц оксида железа.
Методы определения: измерение спектров ЭПР методом стационарной ЭПР-спектроскопии 3-см диапазона.
Приборные средства измерений: Малогабаритный спектрометр электронного парамагнитного резонанса модели ESR-MINI 3-см диапазона. Все измерения осуществлялись в стандартных стеклянных ампулах (капиллярах) диаметром 1,5 мм без вращения. В качестве реперного образца использовался образец дифенил-пикрил-гидразила (ДФПГ) с g-фактором 2,0036.
Параметры регистрации спектров ЭПР: частота ВЧ модуляции 100 кГц, амплитуда модуляции - 5 Гс, мощность СВЧ - 2 – 8 мВт, коэффициент усиления - варьировался, количество сканирований – 1.
Содержание работы:
5. Синтез суперпарамагнитных наночастиц оксида железа в гетерофазных условиях из растворов двух и трехвалентного железа по схеме Элмора-Массарта.
6. Измерение спектров ЭПР водных растворов магнитных наночастиц оксида железа.
Экспериментальные результаты исследований.
На рис.47-49 представлены спектры ЭПР магнитных частиц Fe3O4 в тонкой гекстрановой оболочке в дистиллированной воде. Условия регистрации спектров ЭПР: частота СВЧ f0 = 9,52 ГГц, мощность СВЧ облучения – 2 мВт (для образцов 1 и 2) и 8 мВт (для образца 3); коэффициент усиления – 400 (для образца 1) и 800 (для образцов 2 и 3).
Для этих спектров характерно наличие двух раздельных сигналов с g- факторами
g1 = 2,32 и g2 = 4,19, что обусловлено существованием двух конфигураций комплексов железа Fe3+ (3 d5) и Fe 2+ (3 d6), соответственно. Проведенные нами исследования ЭПР показывают, что форма спектров ЭПР сильно зависит от технологии приготовления образцов, от концентрации и размера наночастиц железа в растворе.
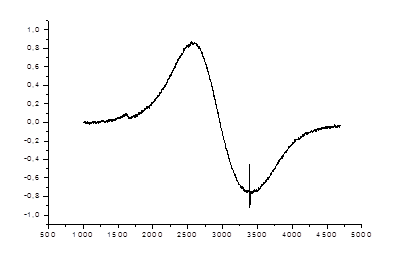
Рисунок 47. Спектры ЭПР оксидов железа в дистиллированной воде (СFe = 10,6 мM/л).
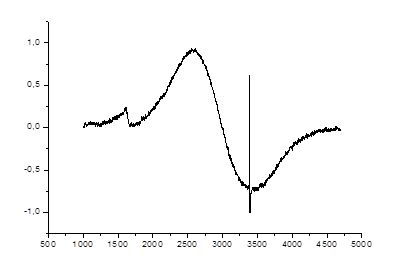
Рисунок 48. Спектры ЭПР оксидов железа в дистиллированной воде (СFe = 2,6 мM/л).
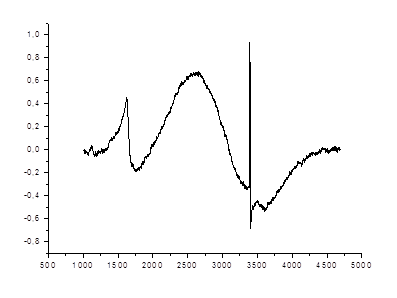
Рисунок 49. Спектры ЭПР оксидов железа в дистиллированной воде (СFe = 1,3 мM/л).
Результаты исследований ЭПР наночастиц оксида железа в дистиллированной воде и водных физиологических растворах (использовался фосфатный буфер с pH = 7,0) в зависимости от концентрации и размера наночастиц, представлены на рисунках 50 - 52.
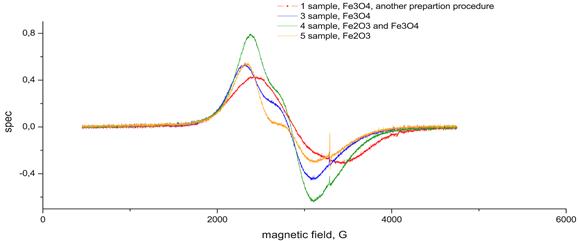
Рисунок 50. Спектры ЭПР суспензии наночастиц оксида железа в дистиллированной воде. Концентрация Fe3+: 1) – 10,5 ммоль/л, 3) – 19,0 ммоль/л, 4) – 31,25 ммоль/л, 5) – 75,9 ммоль/л.
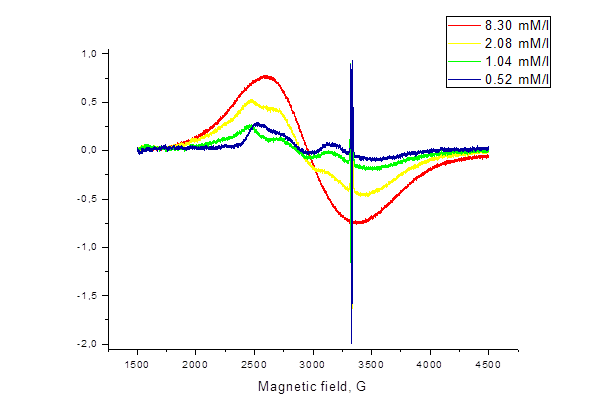 Рисунок 51. Спектры ЭПР суспензии наночастиц оксида железа в физиологическом растворе. Размер наночастиц - менее 200 нм.
Рисунок 51. Спектры ЭПР суспензии наночастиц оксида железа в физиологическом растворе. Размер наночастиц - менее 200 нм.
 Рисунок 52. Спектры ЭПР суспензии наночастиц оксида железа в физиологическом растворе. Размер наночастиц – более 200 нм.
Рисунок 52. Спектры ЭПР суспензии наночастиц оксида железа в физиологическом растворе. Размер наночастиц – более 200 нм.
Сравнительный анализ спектров ЭПР суспензий наночастиц оксида железа как в дистиллированной воде, так и в водных физиологических растворах показывает следующие закономерности:
- с ростом концентрации наночастиц оксида железа происходит увеличение интенсивности и «эффективной» ширины сигналов ЭПР;
- форма линий ЭПР содержит две компоненты – узкий и широкий сигналы, накладывающиеся друг на друга.
Похожая форма линий ЭПР наблюдалась также в исследованиях ЭПР жидких (вода и толуол) и твердых (полимер) суспензий суперпарамагнитных частиц γ-Fe2O3, выполненных группой Ногиновой Н. [61], которые соотнесли данный спектр агрегатам частиц, образуемым в суспензиях.
Нами был проведен сравнительный анализ экспериментальных спектров ЭПР наночастиц оксида железа с моделированными спектрами ЭПР агрегатов металлических наночастиц в коллоидных растворах, полученными Долотовым C..В. и Ролдугиным В.И.[62-64].
В работах [62-64] использован подход, позволяющий моделировать агрегаты с наперед заданной фрактальной размерностью.
В рассматриваемом подходе структура агрегата задается величинами фрактальной размерности и префактора. Построение агрегата осуществлялось путём присоединения одиночных частиц. С использованием этих моделей были построены двух- и трёхмерные агрегаты моно- и полидисперсных наночастиц, содержащие различное число частиц и обладающие различной фрактальной размерностью (рис. 53).
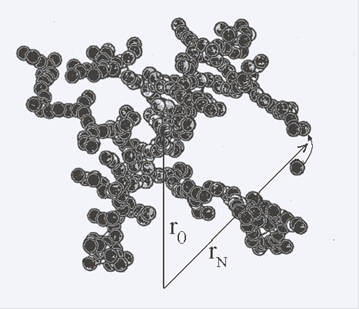
Рисунок 53. Схема построения фрактального агрегата.
При расчёте спектров ЭПР учитывали только наиболее существенное диполь-дипольное взаимодействие спинов электронов, принадлежащих разным частицам. В этом случае магнитные дипольные моменты μ i, наведенные на различных частицах, подчиняются системе уравнений
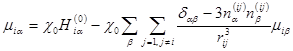 (4)
(4)
где индексы i и j нумеруют частицы, α, β - указывают компоненты
векторов в прямоугольной системе координат, α,β = { x, y, z }, χ0 – восприимчивость изолированной частицы, r ij = r i − r j, n ij = r ij / rij, i r i – радиус вектор центра i -ой частицы, H i (0) – внешнее поле в точке ее расположения.
Система уравнений (4) разрешается, и, с учётом выражения для восприимчивости отдельной частицы, получается выражение для расчёта спектров ЭПР агрегатов металлических наночастиц
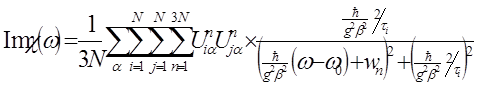 , (5)
, (5)
гдеω0 – резонансная частота, g – электронный g -фактор, β – магнетон Бора, ћ - постоянная Планка, τ i - время релаксации i -й частицы, Uiαn и wn - собственные векторы и собственные значения 3 N -мерной матрицы W с элементами
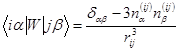 ,
, 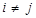 (6)
(6)
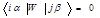 ,
, 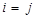 .
.
С помощью соотношений (4-6) были рассчитаны спектры ЭПР построенных агрегатов, в том числе и спектры ЭПР анизотропных агрегатов при различной ориентации внешнего магнитного поля.
В случае полидисперсных наночастиц расчёты были проведены для фрактальных агрегатов, состоящих из 100 частиц, размер которых распределён по нормальному закону при среднем диаметре частиц, равном 10 нм. Приведём спектры для наиболее типичного случая агрегатов с df = 2.2.
При малых значениях среднего квадратичного отклонения σ в спектре наблюдается две накладывающиеся друг на друга линии ЭПР. Когда σ = 0.3 нм, в спектре остаётся только одна линия ЭПР (рис. 54).
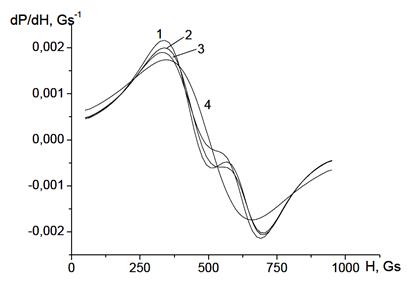
Рисунок 54 - Спектры ЭПР фрактальных агрегатов (df = 2.2), состоящих из полидисперсных частиц, при различных значениях σ: 1 – 0, 2 – 0.1, 3 – 0.2, 4 – 0.3 нм.
Аналогичная картина наблюдается и для агрегатов с другой фрактальной размерностью, при которой спектр исходно расщеплялся. Это объясняется следующим образом. Расщепление спектров агрегатов на линии происходит из-за наличия в них статистически доминирующих расстояний между частицами, на которых взаимодействие достаточно сильно, чтобы проявить себя в спектре. С ростом σ появляется всё большее число частиц разных размеров, что приводит к случайному изменению расстояний между ними и, как следствие, к изменению положения новых резонансных линий. В результате множество линий ЭПР сливаются в одну широкую линию.
Сказанное выше справедливо для агрегатов, в которых частицы разного размера расположены случайным образом друг относительно друга. Проведённое моделирование спектров и анализ упаковки частиц показали, что спектр ЭПР полидисперсных систем зависит от порядка расположения крупных и мелких частиц в агрегате, от того, какие (крупные или мелкие) частицы находятся в центральной части агрегата или на периферии. Так, из рис. 55 видно, что даже при достаточно большом значении σ, равном 0.9 нм, в спектре всё ещё присутствуют две линии ЭПР, когда самые маленькие частицы располагаются в центре агрегата, затем идут частицы большего размера, а самые большие находятся на периферии. (Заметим, что такой порядок распределения частиц, по-видимому, должен соответствовать строению реальных агрегатов, поскольку мелкие частицы обладают большей подвижностью и потому больше склонны к агрегации.)
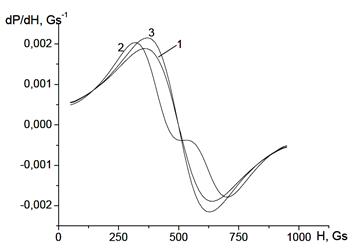
Рисунок 55 - Спектры ЭПР фрактальных агрегатов (df = 2.2), состоящих из полидисперсных чачтиц (σ = 0.9), при случайном (1) и регулярном (2, 3) расположении частиц в агрегате. 2 – самые маленькие частицы расположены в центре, а самые большие – на периферии, 3 – самые большие частицы расположены в центре, а самые маленькие – на периферии.
При обратном порядке расположения частиц спектр состоит только из одной линии. Таким образом, случайный порядок расположения частиц является неким промежуточным вариантом, и расщепление спектра на две линии может наблюдаться даже для агрегатов, состоящих из полидисперсных частиц с довольно большим σ.
Было также прослежено изменение спектра ЭПР агрегата, растущего из полидисперсных частиц (рис. 56). Видно, что на начальной стадии агрегации поведение спектра такое же, как и в случае агрегата, состоящего из монодисперсных частиц. Но для агрегатов, состоящих из 25−100 полидисперсных частиц, наблюдаются заметные различия в характере изменения спектров агрегатов монодисперсных и полидисперсных частиц. Рис. 56 демонстрирует сильное влияние полидисперсности частиц на эволюцию спектра ЭПР.
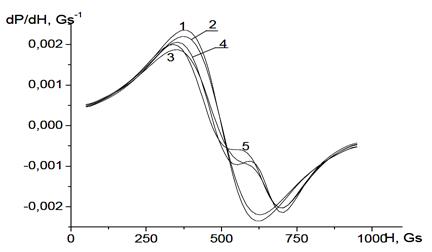
Рисунок 56 - Спектры ЭПР фрактальных агрегатов, состоящих из 5 (1), 10 (2), 25 (3), 50 (4) 100 полидисперсных частиц (5). σ = 0.9 нм, df = 2.2.
Сравнение полученных нами экспериментальных спектров ЭПР суспензий наночастиц оксида железа с моделированными спектрами ЭПР агрегатов металлических наночастиц [62 - 64] показывает, что наиболее вероятно, экспериментальные спектры ЭПР обусловлены агрегатами полидисперсных наночастиц оксида железа, когда самые маленькие частицы располагаются в центре агрегата, затем идут частицы большего размера, а самые большие находятся на периферии.
Таким образом в результате проведенных нами экспериментальных исследований ЭПРсуперпарамагнитных наночастиц оксида железа в водных суспензиях можно сделать следующие выводы:
1) Исследования ЭПР суперпарамагнитных суспензий наночастиц оксида железа в водных растворах и физиологических жидкостях показали наличие спектра ЭПР из двух линий, характерного для агрегатов наночастиц оксида железа, образующихся как в водных растворах, так и в растворах физиологических жидкостей. Вид и характеристики спектров ЭПР зависят от размеров и концентрации наночастиц, их дисперсного состояния, технологии приготовления.
2) Моделирование спектров ЭПР наночастиц и их сравнение с экспериментальными данными показывает наличие фрактальной структуры агрегатов наночастиц оксида железа. Зависимость спектров ЭПР фрактальных агрегатов полидисперсных наночастиц от ширины распределения частиц по размерам, а так же особенностей распределения разных частиц в агрегате показывает возможность использования метода ЭПР для оценки структуры, степени дисперсности наночастиц оксида железа в биологических жидкостях.
Определение оптимальных параметров и условий улучшения контрастных свойств магнитно-резонансных изображений при использовании суперпарамагнитных наночастиц оксида железа в молекулярной МРТ
Молекулярная МРТ основывается на том, что специальные молекулы – маркеры служат источником контраста на изображениях. Контраст в МРТ является результатом различия в сигнале от смежных пикселей или вокселей, сигнал в наибольшей степени зависит от трех основных параметров: протонной плотности, времени спин-решеточной релаксации T 1, и времени спин-спиновой релаксации T 2. Плотность спинов, пропорциональная суммарной намагниченности спиновой системы M 0, отражает общее количество спинов, доступных для получения МР-изображения в пределах данной ткани (или пикселя).
Времена релаксации T 1 и T 2 описывают законы, по которым изменяется спиновая система. T 1 - закон, по которому система возвращается к равновесию после возбуждения энергией РЧ поля. Чем быстрее система возвращается к равновесию, тем больше доступных спинов для возбуждения следующим импульсом.
Спин-спиновая T 2 -релаксация описывает процесс расфазировки МР-сигнала из-за локальной неоднородности магнитного поля, возникающей за счет взаимодействия спинов друг с другом, в результате чего происходит потеря интенсивности МР-сигнала. В общем случае расфазировка спиновых прецессий ядерных моментов вызывается не только спин-спиновыми взаимодействиями, но и наличием неоднородных локальных внешних магнитных полей в объеме образца, обусловленных или неоднородностью постоянного магнитного поля B 0, или градиентными магнитными полями, создаваемыми соседними магнитными моментами других ядер и неспаренных электронов. В этом случае говорят о времени эффективной поперечной релаксации 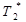 :
:
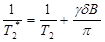 ,
,
где γ – гиромагнитное отношение, δ B – неоднородность локального магнитного поля.
Времена T1 и T2 зависят от нескольких параметров [53]: - резонансной частоты (индукции магнитного поля); - температуры; - подвижности спинов (микровязкости); присутствия больших молекул; - присутствия парамагнитных молекул.
Контраст МР-изображений зависит в большей или меньшей степени от T 1, T 2 или 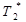 и протонной плотности.
и протонной плотности.
Так как T 1 и T 2 являются основными параметрами контраста МР-изображений, именно эти параметры должны быть изменены любым потенциальным контрастным агентом.
Связь спинов протонов с большими магнитными моментами суперпарамагнитных веществ увеличивает скорость релаксации воды, делая их полезными в качестве контрастных агентов для МРТ. В присутствии суперпарамагнитных веществ, таких как наночастицы оксида железа, времена релаксации ядерных спинов протонов воды, T 1, T 2 и 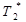 , сокращаются [54]. Что касается T 2 и
, сокращаются [54]. Что касается T 2 и 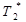 , магнитные наночастицы действуют как магнитные моменты, производящие крошечные градиенты локального магнитного поля, через которые протоны осуществляют диффузию. Так как каждый протон будет иметь отдельный путь через градиентное поле, то разности фаз между протонами будут накапливаться. В результате будет происходить индуцированная различной восприимчивостью расфазировка МР сигнала протона с последующим уменьшением
, магнитные наночастицы действуют как магнитные моменты, производящие крошечные градиенты локального магнитного поля, через которые протоны осуществляют диффузию. Так как каждый протон будет иметь отдельный путь через градиентное поле, то разности фаз между протонами будут накапливаться. В результате будет происходить индуцированная различной восприимчивостью расфазировка МР сигнала протона с последующим уменьшением 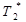 . Это сокращение
. Это сокращение 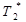 может быть использовано в МРТ-эксперименте, когда наночастицы сильно намагничены.
может быть использовано в МРТ-эксперименте, когда наночастицы сильно намагничены.
При использовании суперпарамагнитных частиц оксида железа релаксация вызвана время- или частотно-модулированными взаимодействиями между протонами и магнитными моментами частиц [55]. Связь может быть дипольного и скалярного характера, а временная или частотная модуляция возникает из-за трансляционной диффузии протонов, вращательной диффузии магнитных частиц и обмена между связанными протонами биомакромолекул и протонами свободной воды.
Есть много факторов, которые потенциально могут повлиять на способность магнитных наночастиц индуцировать уменьшение 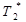 . К ним относятся физические размеры частицы и ее оболочки, химические свойства оболочки и окружающей среды, движение частиц и протонов, и неоднородности в самих частицах. Регулируя размер ядра, толщину оболочки, химию поверхности, и нацеленные на мишень лиганды, зонды наночастиц могут быть ориентированы, чтобы достигать конкретные мишени в виде определенных органов, клеток, или даже молекулярных маркеров различных заболеваний in vivo [56]. Релаксация магнитных наночастиц, как правило, модулируется размером ядра, часто в диапазоне 4-20 нм в диаметре. Однако, меньше известно о влиянии свойств оболочки на индуцированную наночастицами релаксацию. Поскольку многие из этих факторов могут взаимодействовать сложным образом, влияя на релаксацию, то выяснение влияния свойств оболочки на уменьшение
. К ним относятся физические размеры частицы и ее оболочки, химические свойства оболочки и окружающей среды, движение частиц и протонов, и неоднородности в самих частицах. Регулируя размер ядра, толщину оболочки, химию поверхности, и нацеленные на мишень лиганды, зонды наночастиц могут быть ориентированы, чтобы достигать конкретные мишени в виде определенных органов, клеток, или даже молекулярных маркеров различных заболеваний in vivo [56]. Релаксация магнитных наночастиц, как правило, модулируется размером ядра, часто в диапазоне 4-20 нм в диаметре. Однако, меньше известно о влиянии свойств оболочки на индуцированную наночастицами релаксацию. Поскольку многие из этих факторов могут взаимодействовать сложным образом, влияя на релаксацию, то выяснение влияния свойств оболочки на уменьшение 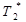 может обеспечить полезную основу для разработки более мощных зондов-наночастиц без необходимости увеличения размера зонда.
может обеспечить полезную основу для разработки более мощных зондов-наночастиц без необходимости увеличения размера зонда.
Для сферической частицы определенного размера ядра, можно представить себе силовые линии магнитного поля, распределенными в пространстве в соответствии с уравнением для диполя [57]. Здесь мы касаемся только Z -компоненты магнитного поля Bz. Магнитные наночастицы вызывают релаксацию 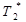 протонов, проходящих через эти градиентные поля наночастиц. Протоны индивидуально накапливают изменения фазы в соответствии с
протонов, проходящих через эти градиентные поля наночастиц. Протоны индивидуально накапливают изменения фазы в соответствии с 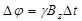 , где Δ t – промежуток времени, в течение которого протон находится в градиентном поле. Поскольку протоны находятся первоначально в фазе, то спад сигнала, из-за расфазировки, происходит из-за градиентного поля частицы, а не от основного магнитного поля. Ядро частицы производит определенное магнитное поле, через которое частицы могут диффундировать. Оболочка частицы, физически исключает диффузию протонов из некоторой области вокруг ядра. Хотя ядро производит то же поле, протоны имеют меньший доступ к более высоким градиентам вблизи частицы. Как результат, предполагается, что протонная релаксация в ситуации частицы с оболочкой будет медленнее, что приводит к наблюдаемому уменьшению скорости релаксации R 2 с ростом размера оболочки.
, где Δ t – промежуток времени, в течение которого протон находится в градиентном поле. Поскольку протоны находятся первоначально в фазе, то спад сигнала, из-за расфазировки, происходит из-за градиентного поля частицы, а не от основного магнитного поля. Ядро частицы производит определенное магнитное поле, через которое частицы могут диффундировать. Оболочка частицы, физически исключает диффузию протонов из некоторой области вокруг ядра. Хотя ядро производит то же поле, протоны имеют меньший доступ к более высоким градиентам вблизи частицы. Как результат, предполагается, что протонная релаксация в ситуации частицы с оболочкой будет медленнее, что приводит к наблюдаемому уменьшению скорости релаксации R 2 с ростом размера оболочки.
Целью данного этапа проекта является определение оптимальных параметров и условий улучшения магнитно-резонансных изображений при использовании наночастиц оксида железа.
Объекты исследований: суперпарамагнитные наночастицы оксида железа в модельных водных растворах: в дистиллированной воде, в 2% геле «агар-агар» (смесь молекул воды и биомакромолекул полисахаридов агарозы и агаропекина), в водном растворе альбумина (50 г/л) (смеси воды и простых, растворимых в воде белков). В дальнейшем последние две смеси мы для упрощения иногда будем называть системой «биополимер-вода».
Магнитно-резонансные изображения изучались in vivo при введении наночастиц оксида железа в ткани мышей.
Приборные средства измерений: Фурье спектрометр ядерного магнитного резонанса СХР-300 (Брукер, Германия) с величиной магнитного поля 7,1 Тл. Все измерения осуществлялись в стандартных стеклянных ампулах диаметром 5 мм без вращения. Для стабилизации поля использовали сигнал дейтериевого резонанса тяжелой воды.
ЯМР релаксометр «Спин Трэк» с величиной магнитного поля 0.33 Тл. Резонансная частота на ядрах протонов - 14 МГц.
Микро ЯМР томограф AVANCE II - 500 (Брукер, Германия). Область исследования 30х30 мм, матрица 256х256 пикселей, толщина среза 1мм, расстояние между срезами 1,5 мм.
Параметры импульсных последовательностей для исследований in vitro
Для получения 1Н ЯМР спектров использовалась одноимпульсная последовательность (длительность 90° импульса 0,5 мкс; длительность паузы между 90° импульсами 3 с; количество повторений 8).
Для измерения времени Т1 использовалась импульсная последовательность «инверсия-восстановление» 180°-t-90° (длительность 90° импульса 4,6 мкс; длительность 180° импульса 9,2 мкс; длительность пауз между 180° и 90° импульсами: от 1 мкс до 10с. 16 экспериментальных точек; длительность паузы между 180° импульсами 10 с).
Для измерения времени спин-спиновой релаксации Т2 применяли модифицированную импульсную последовательность Карра-Парселла (длительность 90° импульса 4,6 мкс; длительность 180° импульса 9,2 мкс; время эхо от 1 мкс до 7 мс для разных образцов; 512 сигналов эхо).
Скорость релаксации R2* вычислялась по ширине линии спектра (R2*=πΔυ1/2), где Δυ1/2 – ширина спектральной линии на половине высоты. Измерения проводились только на частоте 300 МГц, использовалась одноимпульсная последователь (длительность 90° импульса 0.5 мкс, пауза между импульсами 3 с, количество накоплений от 4 до 32 в зависимости от уровня шумов).
Экспериментальные результаты
Измерения спектров ЯМР и времен магнитной релаксациисуперпарамагнитных наночастиц оксида железа в модельных водных растворах проводили в сравнении с водными растворами хлорного железа. Все спектры протонного резонанса имели вид одиночной линии ЯМР воды. Изменения вида спектров при варьировании дисперсий касались только формы линии, которая полностью характеризовалась единственным параметром ширины линии на половине высоты. Результаты измерений ширины линии представлены в графической форме в виде зависимости ширины линии протонов воды в суспензии от концентрации наночастиц. На рис. 20 показана типичная зависимость ширины линии ЯМР 1Н воды от концентрации наночастиц магнетита, покрытых декстраном и глицином, с размером частиц менее 100 нм. Наночастицы магнетита, покрытые глицином и декстраном, близким образом уширяют линии резонанса протонов воды.
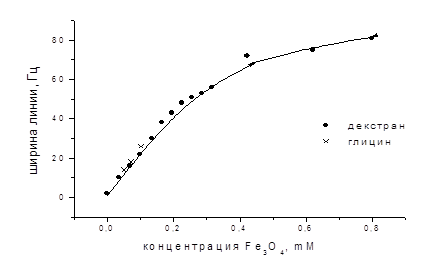
Рисунок 20 – Зависимость ширины линии ЯМР 1Н воды от концентрации наночастиц магнетита, покрытых декстраном и глицином
Поскольку ширина линии ЯМР протонов воды пропорциональна скорости релаксации, то оптимальным для определения параметров контрастирующих свойств МР изображений является изучение экспериментальных зависимостей скоростей релаксации протонов воды в зависимости от концентрации наночастиц в водном растворе.
Полученные экспериментальные значения скоростей релаксации R2*, R2, R1 протонов в различных средах при разных концентрациях суперпарамагнитных наночастиц оксида железа представлены в таблице 4 (для частоты ЯМР 300 Мгц) и таблице 5 (для частоты ЯМР 14 МГц).
Таблица 4 – Скорости релаксации, измеренные на частоте ЯМР 300 МГц в различных средах с разным содержанием наночастиц оксида железа
| 2% гель “агар-агар” с наночастицами оксида железа | Вода дистиллированная с наночастицами оксида железа | Водный раствор альбумина 50 г/л с наночастицами оксида железа | |||||||
| C(Fe3+), мМ/л | R2*, 1/c | R2, 1/c | R1, 1/c | R2*, 1/c | R2, 1/c | R1, 1/c | R2*, 1/c | R2, 1/c | R1, 1/c |
| 0.5 | 345±10 | 208±6 | 0.95±0.02 | 345±10 | 49±1 | 0.72±0.02 | 345±10 | 92±3 | 0.87±0.03 |
| 729±22 | 474±14 | 1.56±0.05 | 537±16 | 78±2 | 1.02±0.03 | 653±20 | 172±5 | 1,10±0.03 | |
| 1341±40 | 870±26 | 2.5±0.1 | 691±21 | 126±4 | 1.69±0.05 | 1000±30 | 287±9 | 1,64±0.05 | |
| 2148±64 | 1466±44 | 4.0±0.1 | 729±22 | 220±7 | 2.61±0.08 | 1303±40 | 459±14 | 2,47±0.07 | |
| 3988±120 | 2564±77 | 6.9±0.2 | 1162±35 | 435±13 | 4.9±0.2 | 1815±54 | 788±24 | 4,2±0.1 | |
| 5872±176 | 3636±109 | 9.7±0.3 | 1570±47 | 690±21 | 7,7±0.2 | 2490±75 | 1299±39 | 7,1±0.2 | |
| 8356±250 | 5236±157 | 13.8±0.4 | 1840±55 | 841±25 | 10,8±0.3 | 3140±94 | 1613±48 | 8,9±0.3 |
Таблица 5 – Скорости релаксации, измеренные на частоте ЯМР 14 МГц в различных средах с разным содержанием наночастиц оксида железа
 По результатам измерений были построены графики зависимости скоростей продольной R1 и поперечной R2 ядерной магнитной релаксациипротонов воды от концентрации суперпарамагнитных наночастиц оксида железа в дистиллированной воде (рис. 21 и 22), в геле “агар-агар” (рис. 23 и 24), в растворе альбумина (рис. 25 и 26) для двух частот ЯМР: 300 и 14 МГц.
По результатам измерений были построены графики зависимости скоростей продольной R1 и поперечной R2 ядерной магнитной релаксациипротонов воды от концентрации суперпарамагнитных наночастиц оксида железа в дистиллированной воде (рис. 21 и 22), в геле “агар-агар” (рис. 23 и 24), в растворе альбумина (рис. 25 и 26) для двух частот ЯМР: 300 и 14 МГц.
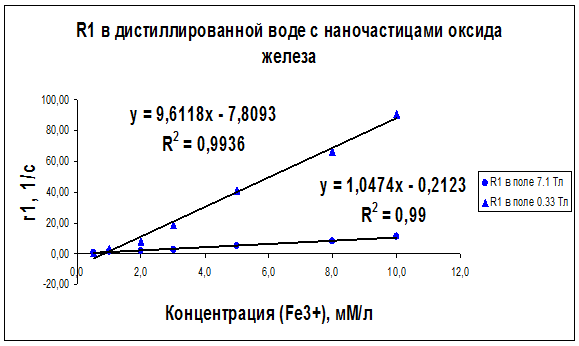
Рисунок 21 – Концентрационная зависимость скорости релаксации R1, полученная на частотах ЯМР 300 Мгц (поле B0 = 7.1 Тл) и 14МГц (поле B0 = 0.33 Тл) для образцов дистиллированной воды с различным содержанием наночастиц оксида железа
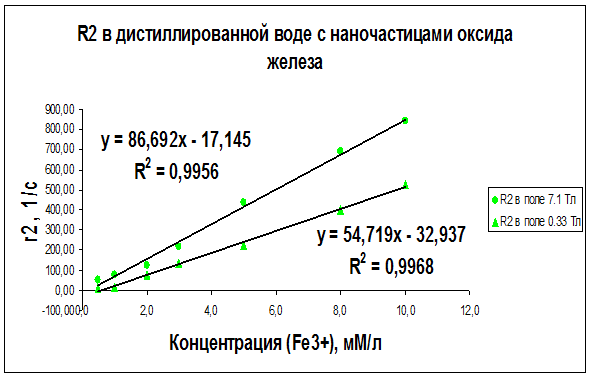
Рисунок 22 – Концентрационная зависимость скорости релаксации R2, полученная на частотах ЯМР 300 МГц (поле B0 = 7.1 Тл) и 14 МГц (поле B0 = 0.33 Тл) для образцов дистиллированной воды с различным содержанием наночастиц оксида железа
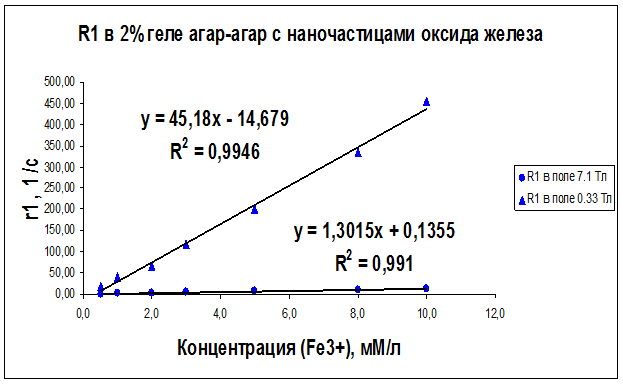
Рисунок 23 – Концентрационная зависимость скорости релаксации R1, полученная на частотах ЯМР 300 МГц (поле B0 = 7.1 Тл) и 14МГц (поле B0 = 0.33 Тл) для образцов геля “агар-агар” с различным содержанием наночастиц оксида железа
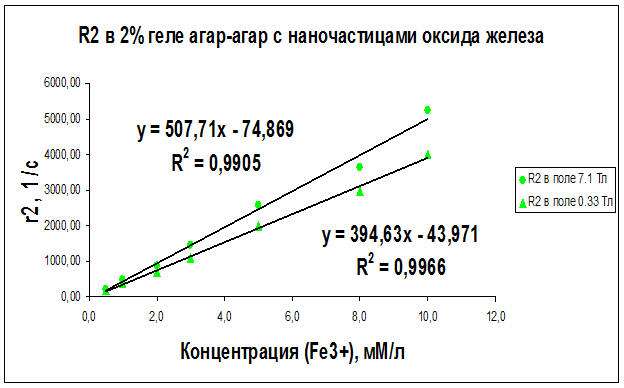
Рисунок 24 – Концентрационная зависимость скорости релаксации R2, полученная на частотах ЯМР 300 МГц (поле B0 = 7.1 Тл) и 14 МГц (поле B0 = 0.33 Тл) для образцов геля “агар-агар” с различным содержанием наночастиц оксида железа
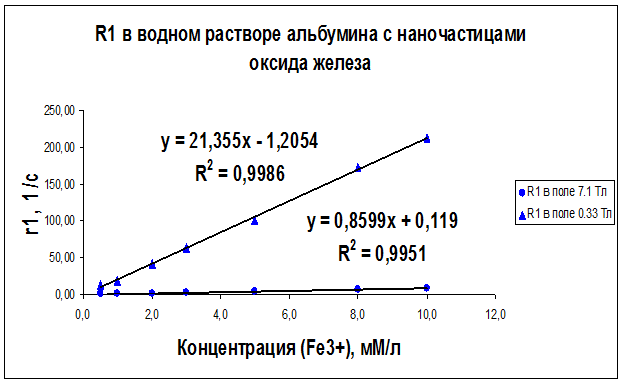
Рисунок 25 – Концентрационная зависимость скорости релаксации R1, полученная на частотах ЯМР 300 МГц (поле B0 = 7.1 Тл) и 14 МГц (поле B0 = 0.33 Тл) для образцов водного раствора альбумина с различным содержанием наночастиц оксида железа
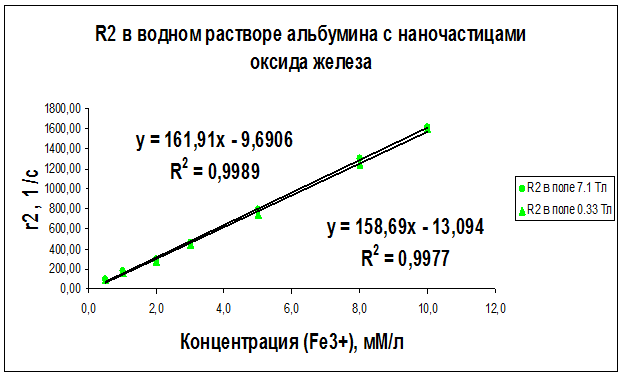
Рисунок 26 – Концентрационная зависимость скорости релаксации R2, полученная на частотах ЯМР 300 МГц (поле B0 = 7.1 Тл) и 14 МГц (поле B0 = 0.33 Тл) для образцов водного раствора альбумина с различным содержанием наночастиц оксида железа
По результатам измерений были также построены графики зависимостей скорости эффективной спин-спиновой (поперечной) R2* ядерной магнитной релаксациипротонов воды от концентрации суперпарамагнитных наночастиц оксида железа в дистиллированной воде (рис. 27), в геле “агар-агар” (рис. 28) и в растворе альбумина (рис. 29) для частоты ЯМР 300 МГц.
Как видно из рисунков 21–29 концентрационные зависимости соответствуют линейной зависимости общего вида Ri = ri∙C + A, где С - концентрация магнитных наночастиц, выраженная в мМ, А - константа, определяемая скоростью релаксации протонов воды в отсутствие суперпарамагнитных наночастиц, коэффициент релаксационной эффективности ri. Анализ концентрационных зависимостей позволяет определить коэффициент релаксационной эффективности ri как тангенс угла наклона экспериментальной зависимости Ri = f (C) и вычислить этот коэффициент по соотношению: ri = (1/C · Тi) (мМ · с/л)-1.
В результате проведенных исследований были определены релаксационные эффективности (релаксивности) ri = (1/C · Тi) (мМ · с/л)-1 суперпарамагнитных наночастиц оксида железа в дистиллированной воде, геле «агар-агар» и водном растворе альбумина (Таблица 6).
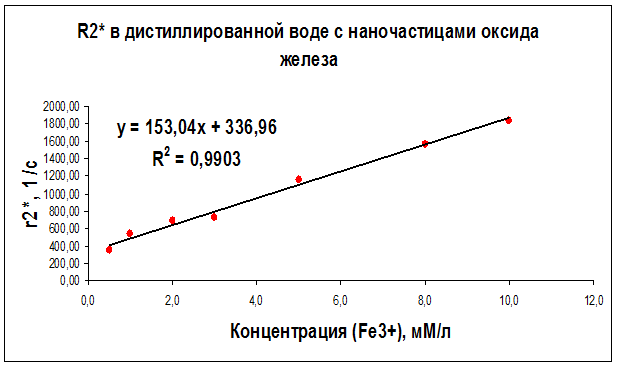
Рисунок 27 – Концентрационная зависимость скорости релаксации R2*, полученная на частоте ЯМР 300 МГц (поле B0 = 7.1 Тл) для образцов дистиллированной воды с различным содержанием наночастиц оксида железа
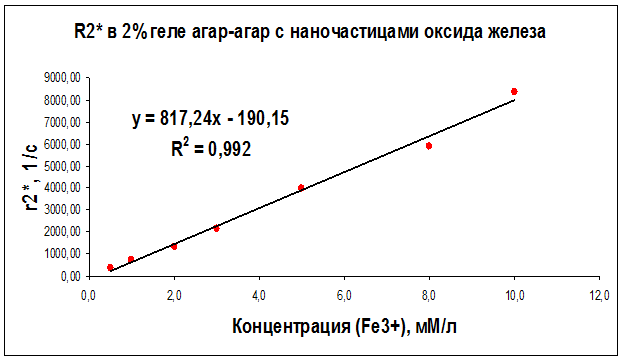
Рисунок 28 – Концентрационная зависимость скорости релаксации R2*, полученная на частоте ЯМР 300 МГц (поле B0 = 7.1 Тл) для образцов геля “агар-агар” с различным содержанием наночастиц оксида железа
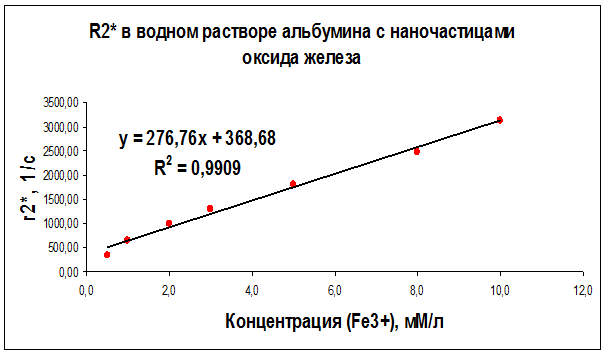
Рисунок 29 – Концентрационная зависимость скорости релаксации R2*, полученная на частоте ЯМР 300 МГц (поле B0 = 7.1 Тл) для образцов водного раствора альбумина с различным содержанием наночастиц оксида железа
Таблица 6 – Релаксационные эффективности наночастиц оксида железа в разных средах, измеренные на частотах 300 МГц и 14 МГц
| Релаксационные эффективности наночастиц оксида железа | В 2% геле агар-агар | В дистиллированной воде | В водном растворе альбумина 50 г/л с | Частота, МГц |
| r2*, л/мМ*с | 817±25 | 153±5 | 277±8 | |
| r2, л/мМ*с | 508±15 | 87±3 | 162±5 | |
| r1, л/мМ*с | 1.30±0.04 | 1.05±0.03 | 0.86±0.03 | |
| r2, л/мМ*с | 395±12 | 54±2 | 159±5 | |
| r1, л/мМ*с | 45±1 | 9.6±0.3 | 21.4±0.6 |
Анализ графиков на рис. 21–29 и данных таблицы 6 доказывает целесообразность использования коэффициента релаксационной эффективности ri для оценки контрастирующей эффективности суперпарамагнитных нанодисперсных частиц оксида железа в водных растворах и системах «биополимер – вода». Эксперименты показали, что чем больше значение коэффициента релаксационной эффективности ri, тем сильнее и лучше контрастирующая способность исследуемых контрастирующих агентов.
Нами разработана методика оптимального определения коэффициента релаксационной эффективности (r) при использовании суперпарамагнитных наночастиц оксида железа в молекулярной МРТ.
В основу этой методики были положены измерения зависимости времен ядерной магнитной релаксации протонов воды от концентрации магнитных наночастиц в суспензии. Релаксационная эффективность магнитных наночастиц определяется как коэффициент r1,2 в эмпирической зависимости скоростей магнитной продольной (R1 = 1/Т1) и поперечной (R2 = 1/Т2) релаксации протонов молекул воды от концентрации магнитных наночастиц в исследуемых растворах
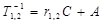 ,
,
где С – концентрация магнитных наночастиц, выраженная в мМ/л, T 1, T 2 – времена продольной и поперечной релаксации (с), соответственно, А – константа, определяемая скоростью релаксации протонов воды в отсутствие наночастиц.
Измерение времен продольной Т 1 и поперечной релаксации Т 2 заключается в определении скорости возвращения спиновой системы протонов к равновесию в постоянном магнитном поле В 0 после воздействия на нее последовательности радиочастотных (РЧ) импульсов на частоте резонанса протонов воды.
Для измерения времени поперечной релаксации Т 2 используется методика, основанная на последовательности импульсов Carr-Purcell-Meilboom-Gill. Для измерения времени Т 1 используется двухимпульсная последовательность инверсии намагниченности 180°-t-90°.
Подготовка к измерению: в стандартные стеклянные ампулы диаметром 5 мм для записи ЯМР спектров вносятся по 500 мкл суспензий и добавляются по 50 мкл тяжелой воды («Изотоп») с тем, чтобы получить сигнал ЯМР дейтерия, необходимый для стабилизации магнитного поля. Концентрация железа в образце определяется переводом суспензии в раствор трехвалентного железа и последующим спектрофотометрическим тестированием тиоцианатного комплекса железа на УФ-спектрофотометре.
Процесс оценки контрастирующих свойств:
1. Образец помещается в датчик ЯМР спектрометра и включается ядерная стабилизация магнитного поля в соответствии с Руководством по работе на приборе.
2. Измерения проводятся при комнатной температуре без вращения образца с числом накоплений сигнала свободной индукции для достижения необходимого отношения сигнал/шум.
3. Времена релаксации измеряются, используя импульсные программы в программном обеспечении ЯМР-спектрометра.
4. Времена релаксации Т 1, Т 2 определяются соответственно по нарастанию и спаду сигнала ядерной индукции протонов воды с помощью программы Origin по методу наименьших квадратов.
5. На основании экспериментальных данных для образцов с различной концентрацией магнитных наночастиц строят зависимость скорости релаксации R1 = 1/ Т 1 и R2 = 1/ Т 2 от концентрации магнитных наночастиц в исследуемых растворах.
3. Зависимость скорости релаксации R1 = 1/ Т 1 и R2 = 1/ Т 2 от концентрации наночастиц аппроксимируется линейной зависимостью по методу наименьших квадратов с использованием программ Excel и Origin. Коэффициент релаксационной эффективности рассчитывается как тангенс угла наклона экспериментальной зависимости Ri = f (C) по соотношению: ri = (1/C · Т i) (мМ · с/л)-1.
Аналогичная методика используется и для определения релаксационной эффективности r2* = (1/C · Т 2*). Единственное отличие заключается в том, что скорость релаксации R2* = 1/ Т 2* вычисляется по ширине линии спектра ЯМР протонов исследуемых растворов (R2*=πΔυ1/2), где Δυ1/2 – ширина спектральной линии на половине высоты.
Для определения условий улучшения контрастных свойств магнитно-резонансных изображений (МРИ) при использовании суперпарамагнитных наночастиц оксида железа в молекулярной МРТ нами были проведены исследования по оптимизации импульсных РЧ последовательностей, используемых для снятия магнитно-резонансных томограмм.
Наночастицы оксида железа оказывают сильное влияние только на времена релаксаций T 2и 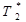 , на Т 1 их влияние незначительное. Поэтому для оптимизации условий снятия МРИ в присутствии наночастиц оксида железа предлагается использование «быстрых» импульсных последовательностей [53], типа быстрое спин-эхо (RSE, RARE, FSE, TSE) и градиентное эхо (GRE, FLASH). Использование «быстрых» импульсных последовательностей сокращает время исследований, что позволяет избежать появления артефактов от движений пациентов без потери качества изображений.
, на Т 1 их влияние незначительное. Поэтому для оптимизации условий снятия МРИ в присутствии наночастиц оксида железа предлагается использование «быстрых» импульсных последовательностей [53], типа быстрое спин-эхо (RSE, RARE, FSE, TSE) и градиентное эхо (GRE, FLASH). Использование «быстрых» импульсных последовательностей сокращает время исследований, что позволяет избежать появления артефактов от движений пациентов без потери качества изображений.
Последовательности «быстрое спин-эхо»
Интенсивность сигнала в стандартной последовательности «спин-эхо»:
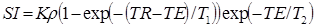 ,
,
где K – константа, зависящая от кровотока, диффузии, перфузии и других параметров, ρ – протонная плотность, TE – время эхо, TR – время повторения. Диаграмма импульсной последовательности «спин-эхо» представлена на рисунке 30.
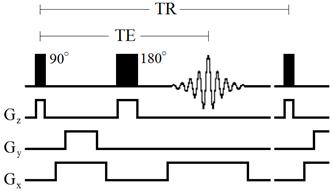
Рисунок 30 – Диаграмма импульсной последовательности «спин-эхо»
При нескольких сигналах эхо эта последовательность называется «мульти-эхо» последовательностью. Контраст МР-изображений здесь зависит в большей степени от T 2, особенно, при длительных TR и TE.
На рисунке 31 представлены МР-изображения печени мыши, полученные с использованием импульсной последовательности «мульти-эхо» с параметрами TE =10 мс, TR =2000 мс, 16 эхо.
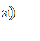
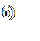
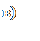
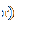
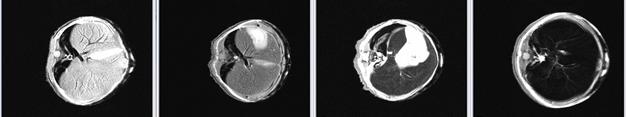
Рисунок 31 – МР-изображения печени мыши, полученные с использованием импульсной последовательности «мульти-эхо»: а) – контроль, б) – контраст на основе наночастиц оксида железа 0,1 мг/мл, в) - 1,0 мг/мл, г) - 10,0 мг/мл
В последовательности RARE – модифицированной «мульти-эхо» последовательности (рисунок 32) каждый сигнал эхо регистрируется при воздействии определенного фазово-кодирующего градиента. Каждый сигнал эхо используется для заполнения соответствующей строки матрицы k-пространства одного или двух изображений. Обычно используется от 8 до 16 сигналов эхо [53].
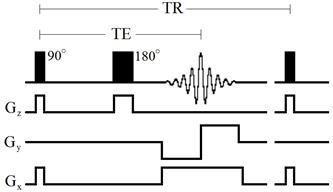
Рисунок 32 – Диаграмма модифицированной «мульти-эхо» последовательности
На рисунке 33 представлены МР Т2-взвешенные изображения печени мыши, полученные с использованием импульсной последовательности RARE, с параметрами TE=12 мс, TR=4200 мс, 16 эхо.
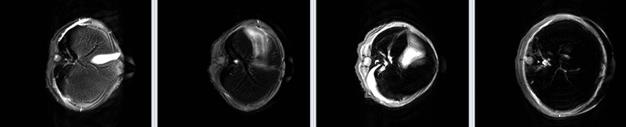
Рисунок 33 – МР Т2-взвешенные изображения печени мыши, полученные с использованием импульсной последовательности RARE: а) – контроль, б) – контраст на основе наночастиц оксида железа 0,1 мг/мл, в) - 1,0 мг/мл, г) - 10,0 мг/мл
На рисунке 34 представлены МР Т1-взвешенные изображения печени мыши, полученные с использованием импульсной последовательности RARE с параметрами TE=7.5 мс, TR=1500 мс, 16 эхо.
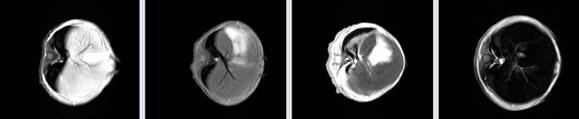
Рисунок 34 – МР Т1-взвешенные изображения печени мыши, полученные с использованием импульсной последовательности RARE: а) – контроль, б) – контраст на основе наночастиц оксида железа 0,1 мг/мл, в) - 1,0 мг/мл, г) - 10,0 мг/мл
Градиентные последовательности
Интенсивность сигнала в последовательности градиентное эхо (GRE) определяется соотношением:
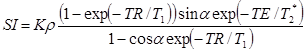 ,
,
где α – угол отклонения вектора намагниченности, TE – время эхо, TR – время повторения.
Контраст МР-изображений при использовании такой импульсной последовательности сильно зависит от времени 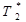 . Диаграмма импульсной последовательности градиентное эхо представлена на рисунке 35.
. Диаграмма импульсной последовательности градиентное эхо представлена на рисунке 35.
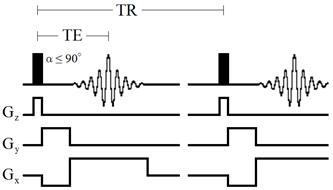
Рисунок 35 – Диаграмма импульсной последовательности градиентное эхо
Среди быстрых градиентных последовательностей чаще применяют последовательности GRE. Градиентные последовательности позволяют использовать короткие TR. Интенсивность сигнала после серии 90ºимпульсов уменьшается и полностью исчезает, когда система достигает состояния равновесия (насыщения). В таких условиях более эффективны импульсы с углом отклонения менее 90º.
Градиентные последовательности, имеющие короткие TR, называют FLASH.
Интенсивность сигнала для быстрых импульсных FLASH последовательностей, если TR меньше T1, но больше T2*, или при использовании специальных очищающих градиентных полей для устранения поперечных когерентностей, можно определить из следующего соотношения:
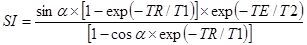 ,
,
где 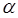 - угол отклонения; TR – время повторения; TE – время эхо; T1 – время спин-решеточной релаксации, T2 – время спин-спиновой релаксации.
- угол отклонения; TR – время повторения; TE – время эхо; T1 – время спин-решеточной релаксации, T2 – время спин-спиновой релаксации.
К основным параметрам (TR, TE и TI) последовательность FLASH добавляет угол отклонения α. Градиентные последовательности, как и спин-эхо последовательности позволяют получать взвешенные изображения в зависимости от времени повторения эхо, угла отклонения, вида последовательности.
В последовательности FLASH интенсивность сигнала достигает максимального значения при угле отклонения 30-60º.
В последовательности «очищенная FLASH» полностью устраняется влияние поперечных когерентностей с помощью градиентных полей, восстанавливая естественный контраст последовательности «частичное насыщение».
В градиентной последовательности с усиленным контрастом (CE-FLASH) T2-взвешенность зависит от значений TR и TE. При больших TE T2-взвешивание лучше, но отношение сигнал/шум ухудшается.
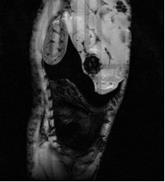
На рисунке 36 представлены МР-изображения мыши, полученные с использованием импульсной последовательности градиентное эхо с параметрами TE = 5 мс, TR = 500 мс.
а) 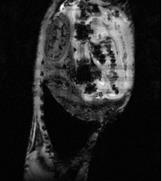
 b)
b)
Рисунок 36 – МР-изображения мыши, полученные с использованием импульсной последовательности градиентное эхо: а) – контроль, б) – контраст на основе наночастиц оксида железа 1,0 мг/мл
Таким образом, в ходе исследований была разработана общая методология получения суперпарамагнитных наночастиц, пригодных для неинвазивной инструментальной диагностики методом молекулярной МРТ. В соответствии с основными принципами разработанной методологии были синтезированы лабораторные образцы суперпарамагнитных наночастиц оксида железа, обеспечивающих повышение контраста МРТ изображений при сканировании животной модели мышей. На наличие контрастирующих свойств препаратов указывали значения удельной намагниченности, коэффициентов релаксационной эффективности и прямые наблюдения гипоинтенсивных МР-изображений органов при внутривенном введении магнитных наночастиц в организм мыши (рисунки 31, 33, 34, 36).
5.1. Теоретическое моделирование эффекта внерезонансного насыщения в молекулярно-клеточных структурах, содержащих нанодисперсные частицы оксида железа, для усиления контрастности магнитно-резонансных изображений
Внерезонансное насыщение (ВРН) – новый перспективный метод МРТ, который значительно увеличивает контрастность изображений, особенно при детектировании специфичных биомаркеров раковых заболеваний – суперпарамагнитных наночастиц оксида железа in vivo.
Недавние разработки новых МР-контрастных агентов и новых методов МРТ с улучшенными чувствительностью и контрастностью изображения быстро нашли распространение в применениях молекулярно-клеточной МРТ [49–52]. По сравнению с парамагнитными металло-хелатами с низким молекулярным весом, такими как Gd-DTPA, суперпарамагнитные наночастицы (Fe3O4 [53–55], MnFe2O4 [56], нанокристаллы FeCo [57]) продемонстрировали существенно более высокие молярные релаксивности и улучшенную чувствительность для in vivo МРТ. Поверхностная функциональность суперпарамагнитного оксида железа (SPIO) обеспечила многочисленные примеры контрастных агентов-мишеней, которые специфично распознают маркеры раковых заболеваний, такие как рецепторы трансферрина [58], фолата [59], и Her-2/neu [60, 61]. После присоединения к мишени-маркеру или после вхождения в клетку наночастицы SPIO могут создавать существенные возмущения в локальных магнитных полях, приводя к быстрой расфазировке спинов протонов и потере интенсивности сигнала магнитного резонанса. T 2 или T 2*-взвешенные методы МРТ – наиболее общие, применяемые для контрастирования изображений в случае использования наночастиц SPIO. T 2*-взвешенные изображения, получаемые с помощью импульсных последовательностей градиентного эхо (GRE) часто имеют низкие отношения сигнал/шум. T2*-взвешенная МРТ высокочувствительна к магнитной восприимчивости, продуцируемой присутствием агентов на основе SPIO, вызывая значительное уменьшение сигнала МР, зависящее от эффективных размеров аккумулированных SPIO агентов. Конечно, исчезновение изображения от влияния SPIO агентов может быть труднее дифференцировать относительно других исчезновений сигнала, вызываемых, например, некоторой магнитной анизотропией вследствие наличия границы раздела тканей. В отличие от этих ограничений, в некоторых недавних исследованиях приводятся сообщения о новых МРТ-методиках, позволяющих потенциально улучшить контрастность МР изображений с помощью агентов на основе SPIO [62–69]. Так Сеппенвульде и др. сообщили о методике, называемой «Белый маркер», разработанной для того, чтобы проследить за парамагнитными маркерами, установленными в катетере, вставляемом в свиную абдоминальную аорту [62]. Положительный контраст был достигнут расфазировкой спиновых прецессий протонов основного сигнала, в то время как на сигнал рядом с маркерами дипольное поле, генерируемое ими, не действовало.
Каннинхам и др. сообщили об использовании похожего метода, чтобы получить позитивный контраст от клеток, меченых суперпарамагнитными наночастицами [63]. В другой работе меченые SPIO стволовые клетки в крысином сердце были визуализированы с помощью методики «a sweep imaging with Fourier transformation (SWIFT) technique», в которой ядра возбуждались свипируемым радиочастотным полем вместе с одновременной обработкой сигнала [64].
Недавно, Зуркия и др. [67] и научная группа Джинминг Гао [68, 69] сообщили о применении метода внерезонансного насыщения для продуцирования позитивного контраста от SPIO наночастиц. Эта методика включала применение насыщающего РЧ-импульса на внерезонансной частоте, и позитивный контраст был получен взятием отношения или вычитания изображений с насыщением и без насыщения. Результаты предварительных исследований [69] продемонстрировали эффективность метода ВРН для детектирования in vivo раковых мишеней – суперпарамагнитных полимерных мицелл (СППМ) в мышах, больных раком. Разработка и применение ультрачувствительных СППМ вместе с методом ВРН обеспечили значительное усиление чувствительности детектирования МРТ вплоть до пикомолярного диапазона концентраций наночастиц. Метод ВРН также позволил улучшить контрастность изображения по сравнению с обычным методом T2-взвешенного изображения. Способность обеспечить увеличенные чувствительность и контрастность МР изображений при продуцировании позитивного контраста сделали ВРН многообещающим методом для молекулярной МРТ.
Теоретическая модель эффекта ВРН
Когда наночастица SPIO намагничивается внешним магнитным полем, времена релаксации соседних протонов воды сильно укорачиваются. При этом предполагается, что все молекулы воды внешней сферы имеют быструю диффузию в шкале ЯМР-времени, и что сигнал от основной массы воды может характеризоваться одиночным набором времен поперечной (T2) и продольной (T1) релаксации. После приложения слабого гладкого длительного РЧ волнового импульса с уровнем мощности ὠ 1 (ὠ 1 = 2π B1, B1 в Гц) и расстройкой частоты Ω в течение времени t, динамику намагниченности ослабленного сигнала воды можно описать уравнением Блоха:
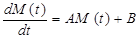 , (29)
, (29)
где 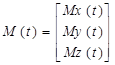 ,
, 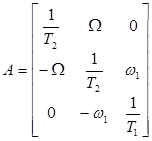 ,
, 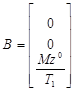 ,
,
Mz 0 – Z-компонента равновесной намагниченности в статическом внешнем магнитном поле. Решение уравнения Блоха (29) может быть выражено как
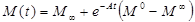 , (30)
, (30)
где M0 – вектор намагниченности в начальном состоянии до насыщения, и M∞- намагниченность в устойчивом состоянии,
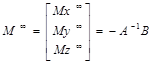 (31)
(31)
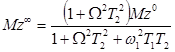 . (32)
. (32)
Отметим, что второй член в уравнении (30) представляет собой разность намагниченностей в первоначальном и устойчивом состояниях, модулированную зависящей от времени функцией e- At (e- At конвергируется в 0 при t → ∞).
Уравнение (32) – основное для нахождения Z -намагниченности в устойчивом состоянии (Mz∞ далее обозначается как Mz) и понимания ее взаимосвязи с параметрами МРТ. Зависимость Z -намагниченности от мощности РЧ насыщения (ὠ 1), расстройки частоты насыщения (Ω) и времен релаксации T 1 и T 2 может быть предсказана и оценена с помощью этого уравнения. На отношение Z -намагниченностей (Mz/Mz0) [70] водного раствора при данных временах релаксации T 1 и T 2 сильно влияет расстройка частоты насыщения (Ω). При частоте насыщения, расположенной далеко от пика связанной воды, |Ω|→∞, отношение Mz / Mz 0 приблизительно равно 1, поскольку член Ω2T22 становится доминирующим фактором в уравнении. Другими словами, интенсивность ВРН пренебрежимо мала из-за того, что намагниченности в начальном и устойчивом состояниях эквивалентны. Наоборот, уменьшение отношения Mz / Mz 0 или более ярко выраженный контраст ВРН ожидается, когда установка частоты насыщения приближается к резонансной частоте воды, или |Ω|→0 м.д. Член Ω2T22 становится менее доминирующим и времена релаксации играют большую роль во влиянии на интенсивность ВРН, приводя к меньшему отношению Mz / Mz 0.
В работе [69] было рассмотрено ВРН растворов СППМ и его зависимость от частоты насыщения и концентрации СППМ. Для томографии ВРН in vivo использовались заранее определенные параметры визуализации, такие как мощность насыщения ὠ 1 и расстройка частоты Ω.
С этими известными параметрами можно предсказать и оценить интенсивность ВРН (Mz / Mz 0). Чтобы проверить это, уравнение (32) можно преобразовать так, чтобы получить упрощенную модель для оценки интенсивности ВРН растворов СППМ.
Уравнение (32) может быть преобразовано к виду
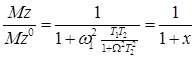 (33)
(33)
где 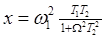 , которое далее приводится к
, которое далее приводится к 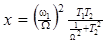 .
.
В условиях ВРН с относительно большим значением Ω (например, Ω ≥ 900 Гц или 3 м.д.), где 1/ Ω2<< T22, уравнение (33) станет равным:
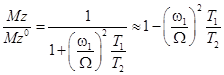 (34)
(34)
Уравнение (34) показывает линейное соотношение между интенсивностью ВРН и временем продольной релаксации (T1) и обратно пропорционально времени поперечной релаксации (T2) растворов СППМ при данной мощности насыщения и частоте.
Для образцов тканей уравнение (34) может быть далее преобразовано таким образом, чтобы показать корреляцию между интенсивностью ВРН и концентрацией СППМ [69]:
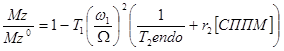 (35)
(35)
где 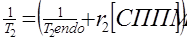 , и T2endo – время эндогенной T 2 релаксации.
, и T2endo – время эндогенной T 2 релаксации.
Так как T2endo длиннее чем 200 мс и пробы СППМ имеют высокие r2 значения, то 1/ T2endo << r2 [ СППМ ]. Уравнение (35) тогда станет:
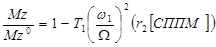 (36)
(36)
Линейное соотношение между интенсивностью ВРН и концентрацией СППМ предсказывается уравнением (36). Эти уравнения показывают, что интенсивность ВРН сильно зависит от T2-релаксивности и концентрации СППМ проб в дополнение к ее зависимости от мощности насыщения и расстройки частоты. Важно отметить, однако, что похожее замещение (1/ T1endo + r1 [ СППМ ]) для 1/ T1 не будет упрощать рассматриваемое уравнение из-за того, что оба члена будут наиболее вероятно одного и того же порядка величины. Это из-за того, что СППМ не являются эффективными T1 релаксационными агентами с низкими значениями r1 .
Данная теоретическая аппроксимированная модель контрастирования МР изображений методом ВРН была экспериментально подтверждена в исследованиях с суперпарамагнитными полимерными мицеллами (СППМ) с прецизионно контролируемыми структурными свойствами [69]. Отобранные по размеру, монодисперсные наночастицы Fe3O4 (6.1 ± 0.2 нм) были использованы для образования ряда СППМ нанопроб со специфично контролируемой толщиной короны (венца) с помощью 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-methoxypoly(ethylene glycol) (DSPE-PEG) с различными PEG молекулярными весами (Рис. 27).
Для количественной оценки эффекта ВРН используют коэффициент ВРН или отношение ВРН, определяемое как
K ВРН = 1 -(Msat / M0),
где Мsat – интенсивность изображения при ВРН, М0 –интенсивность изображения без насыщения. Это отношение аналогично по смыслу коэффициенту переноса ядерной намагниченности (MTR). Усиление эффекта ВРН характеризуется более высокими значениями отношения ВРН.
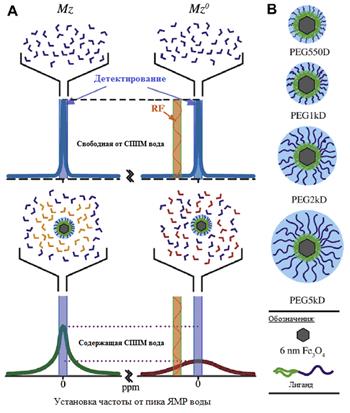
Рисунок 27 – (А) Иллюстрация механизма СППМ индуцированного ВРН контраста и (В) схематическое представление СППМ различной длиной PEG короны, но одного и того же Fe3O4 ядра. В ВРН контрасте импульс внерезонасного РЧ насыщения воздействует только на СППМ-содержащие протоны воды. Вследствие быстрой диффузии воды и большой длительности РЧ импульса устойчивое состояние достигается с меньшей интенсивностью сигнала.
Сравнение методов ВРН и МТ
Метод внерезонансного насыщения, применяемый для SPIO наночастиц, по своей технической реализации в случае слабых магнитных полей идентичен методу внерезонансного насыщения, применяемого для наблюдения эффекта переноса ядерной намагниченности (magnetization transfer - MT) [71]. В случае использования SPIO наночастиц in vivo эти два эффекта часто накладываются друг на друга. Поэтому, чтобы дифференцировать эти два эффекта необходимо знать особенности метода внерезонансного насыщения в случае эффекта переноса ядерной намагниченности. В методе переноса ядерной намагниченности в системе биополимер – вода [72] производится насыщение протонов макромолекул не на частоте резонанса протонов воды, но, конечно, в пределах резонансной линии протонов биополимера, поэтому термин «внерезонансное» следует понимать условно. Происходит процесс переноса ядерной намагниченности от мало подвижных протонов в биополимере на протоны свободной воды, и эффективность этого переноса можно наблюдать по уменьшению сигнала ЯМР от протонов воды по сравнению с сигналом, принятым от них в отсутствии насыщения протонов макромолекул. Однако намагниченность не может быть передана от протонов в биополимере непосредственно протонам подвижной воды, так как время их взаимодействия слишком мало. Поэтому такой перенос возможен лишь при наличии молекул воды, присоединенных к биополимеру и живущих достаточно долго в этом положении. Существование такого взаимодействия (гидратации) не подвергается сомнению [73], хотя его природа достаточно сложна и понятна не до конца. Механизмы передачи ядерной спиновой намагниченности в молекулярно-клеточных структурах рассмотрены нами подробно в п. 1.1.
Схематически основные этапы переноса намагниченности представлены на рис. 28.
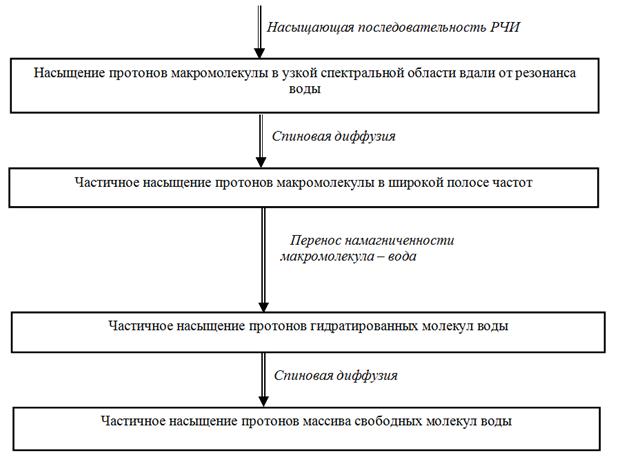
Рисунок 28 – Схематическое представление процесса переноса намагниченности в системе «макромолекула – свободная вода».
Насыщающие РЧИ действуют («выжигают») только в узком частотном диапазоне (рис. 29), но из-за того, что линию биополимера в слабом магнитном поле можно считать однородно уширенной [90], эффект насыщения распространяется по всей ширине линии («спиновая диффузия»), на рис. 29 – широкая линия малой интенсивности. Так как спиновые подсистемы контактируют между собой, то протоны биополимера выводят из равновесия протонную систему воды, уменьшая продольную компоненту ее намагничености (узкая линия малой интенсивности).
Рисунок 29 – Наглядное представление изменений спектральных линий в процессе переноса насыщения:
 – исходный спектр биополимера;
– исходный спектр биополимера;
– исходный спектр воды;
– локально насыщенная («выжженная») линия биополимера;
(широкая) – линия биополимера, ослабленная спиновой диффузией;
(узкая) – линия воды, передавшая намагниченность подсистеме спинов биополимеров.
Таким образом, эффект ВРН в присутствии SPIO отличается от эффекта переноса ядерной намагниченности (МТ) тем, что он основывается на том, что диффузия молекул воды проходит вдоль определенных разделительных областей, которые определяются границами изоповерхностей магнитного поля, а не обязательно каким-то физическим разделением. В эффекте переноса ядерной намагниченности происходит химический или какой-то другой физический обмен протонами [71]. Для того, чтобы определить, что ВРН в присутствии SPIO происходит не вследствие переноса ядерной намагниченности, этот эффект был изучен в растворах с различным pH. Госсуин и др. [74, 75] предварительно использовали этот подход, чтобы различить эффекты внешней и внутренней сфер. Группы OH, локализованные на поверхности частиц, показывают амфотерный характер (см. рис. 30).
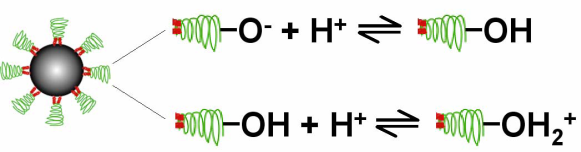
Рисунок 30 – Группы OH, локализованные на поверхности частиц, имеют различное число обмениваемых протонов в зависимости от pH.
При низких значениях pH, поверхность более протонирована, увеличивая число потенциально обменноспособных протонов, что приводит к более выраженной релаксации.
Протонный обмен от этих групп может управляться изменением pH. Так как изменения в pH воздействуют на скорость обмена, то изменения в pH будут действовать на процесс переноса ядерной намагниченности, в то время как эффект ВРН в присутствии SPIO, в основном зависящий от диффузии, должен оставаться постоянным при изменениях в pH, для которых наночастицы остаются стабильными. Рисунок 31 показывает, что независимость отношения ВРН от pH для наночастиц Feridex предполагает, что происходит процесс вследствие диффузии, а не от обмена, как в случае переноса намагниченности [67].
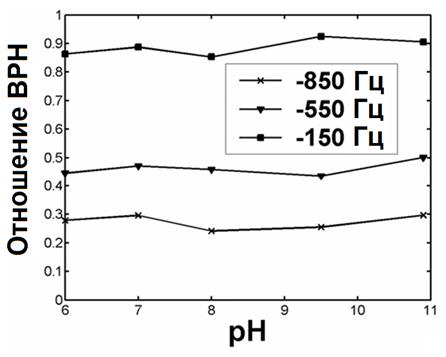
Рисунок 31 – Зависимость коэффициента ВРН (отношения ВРН) от pH для разных значений расстройки частоты.
В применениях in vivo, где используются наночастицы SPIO, чаще всего эффекты MT и ВРН аддитивны. Если желательно разделить эти эффекты, то необходимо сначала оценить эффе
 2015-06-28
2015-06-28 2961
2961







