Основание - это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя.
Концентрация отрицательных ионов растворителя может увеличиваться также за счет растворения некоторых соединений содержащих соответствующие радикалы. Из этих соединений лучше всего диссоциируют щелочи. В водных растворах щелочами являются гидроксиды - KОН, Ba(OH)2, в жидком аммиаке к щелочам относятся дигидронитриды - KNH2, Ba(NH2)2.
Электронная теория. Согласно электронной теории, разработанной Льюисом, основание - это соединение, поставляющее электронные пары для образования химической связи, - донор электронных пар; кислота - вещество, принимающее электронные пары, - акцептор электронных пар, кислотно-основное взаимодействие. согласно электронной теории, заключается в образовании донорно-акцепторной связи. В результате взаимодействия кислоты с основанием образуются солеподобные вещества, называемые аддуктами, Часто (но не всегда) их удается выделить как индивидуальные соединения.
Ниже приведено несколько примеров реакций, которые, согласно электронной теории, представляют кислотно-основное взаимодействие:
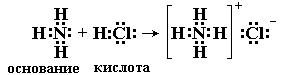
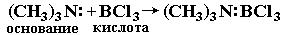
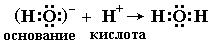
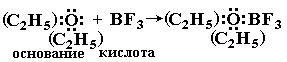
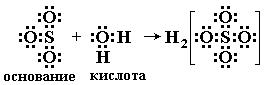
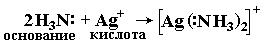
Таким образом, электронная теория Льюиса рассматривает нейтрализацию в водных растворах, взаимодействие аминов с галогенидами бора, комплексообразование, реакции ангидридов с водой как сходные процессы. Вещества, являющиеся донорами электронных пар, называют основаниями Льюиса, а акцепторы электронных пар - кислотами Льюиса.
К основаниям Льюиса относятся галогенид-ионы, вещества, содержащие аминный азот (аммиак, алифатические и ароматические амины, пиридин и т. п.), кислородсодержащие соединения общей формулы R2CO, где R - органический радикал или атом галогена.
кислотами Льюиса являются галогениды бора, алюминия, кремния, олова, фосфора, мышьяка, сурьмы и, многих других элементов, ионы-комплексообразователи Ag+, Co3+, Cr3+ , Pt2+, и др.
Многие аддукты находят практическое применение. Например, широко используемый в качестве катализатора в органических синтезах BF3 часто вводят в реакцию в виде «эфирата» (C2H5)2O:BF3. С твердым солеподобным эфиратом удобнее работать, чем с газообразным BF3.
 2015-06-24
2015-06-24 421
421







