основание - электролит, при диссоциации которого образуются только анионы ОН-.
| основание | Растворимость основания [моль/л] | Сила основания | Константа диссоциации | |
| LiOH - гидроксид лития | р [12,9 г/100г H2O] | щелочь* | К = 6,75 . 10-1 | |
| NaOH - гидроксид натрия | р [113 г/100г H2O] | щелочь | К = 5,9 | |
| KOH - гидроксид калия | р [117,9 г/100г H2O] | щелочь | К = | |
| RbOH - гидроксид рубидия | р [179 г/100г H2O] | щелочь | К = | |
| CsOH - гидроксид цезия | р [303 г/100г H2O] | щелочь | К = | |
| * - LiOH - сильное основание, но по растворимости и силе уступает гидроксидам остальных s-элементов I группы. LiOH NaOH KOH RbOH CsOH ® возрастает сила основания; Гидроксиды ЭОН - бесцветные очень гигроскопические вещества; при накаливании возгоняются без разложения (дегидратация до плавления наблюдается только у LiOH); хорошо растворяются в воде, при этом выделяется значительное количество теплоты | ||||
| Be(OH)2 - гидроксид бериллия* | н [8 . 10-6 ] | амфотерный гидроксид | К1 = К2 = | |
| Mg(OH)2 - гидроксид магния | н (м) [5 . 10-4] [0,00064 г/100г H2O] | слабое основание | К1 = К2 = 2,5 . 10-3 | |
| Ca(OH)2 - гидроксид кальция | р (м) [2 . 10-2] [0,155 г/100г H2O] | сильное основание | К1 = К2 = 4,3 . 10-2 | |
| Sr(OH)2 - гидроксид стронция | р [7 . 10-2] [1,01 г/100г H2O] | щелочь | К1 = К2 = 1,5 . 10-1 | |
| Ba(OH)2 - гидроксид бария | р [2 . 10-1] [3,89 г/100г H2O] | щелочь | К1 = К2 = 2,3 . 10-1 | |
* - Be(OH)2 - полимерное соединение, в воде не растворяется; получение гидроксида бериллия и его отношение к кислотам и щелочам можно выразить следующей суммарной схемой: [Be(OH2)4]2+ 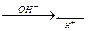 Be(OH)2 Be(OH)2 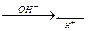 [ Be(OH)4]2- Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 ® усиливается основной характер основания; Гидроксиды Э(ОН)2 - более слабые основания, чем гидроксиды щелочных металлов; они термически не стабильны - теряют воду до плавления [ Be(OH)4]2- Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 ® усиливается основной характер основания; Гидроксиды Э(ОН)2 - более слабые основания, чем гидроксиды щелочных металлов; они термически не стабильны - теряют воду до плавления | ||||
| B(OH)3 – гидроксид бора [H3BO3 – ортоборная кислота] | р [5,74 г/100г H2O] | слабая кислота | К1 = 5,8. 10-10 К2 = 1,8 . 10-13 К3 = 1,6 . 10-14 | |
| Al(OH)3 – гидроксид алюминия * | н | амфотерный гидроксид | К1 = К2 = К3 = 1,38 . 10-9 | |
| Ga(OH)3 – гидроксид галлия | н | амфотерный гидроксид | К1 = К2 = 1,6 . 10-11 К3 = 4 . 10-12 | |
| In(OH)3 – гидроксид индия | м | амфотерный гид-роксид (основн. св-ва преобл. над кислотными) | К1 = К2 = К3 = | |
| TlOH – гидроксид таллия (I) | р [34,3 г/100г H2O] | основной гидроксид | К > 10-1 | |
| Tl(OH)3 – гидроксид таллия (III) | н | слабо амфотерный гидроксид ** | К1 = К2 = К3 = | |
| * - Al(OH)3 - полимерное соединение; природный гидроксид (минерал гидраглит) имеет слоистую кристаллическую решетку, слои состоят из октаэдров Al(OH)6, между слоями действует водородная связь; получаемый по обменной реакции гидроксид – студенистый белый осадок, при стоянии осадок постепенно (с выделением воды) переходит в кристаллическое состояние. ** - кислотная функция выражена очень слабо и практически не проявляется Ga(OH)3, In(OH)3, Tl(OH)3 - нерастворимые в воде студенистые осадки неопределенного состава - получают аналогично Al(OH)3 Ga(OH)3, In(OH)3, Tl(OH)3 ® усиление основных свойств и ослабление кислотных признаков, что находится в соответствии с увеличением размеров атомов Э (III) | ||||
| CuOH - гидроксид меди (I)* | К = | |||
| Cu(OH)2 - гидроксид меди (II) | н | слабое основание | К1 = К2 = 3,4 . 10-7 | |
| AgOH - гидроксид серебра* | К = 5,0 . 10-3 | |||
| Au(OH)3 - гидроксид золота | м | амфотерный гидроксид (кисл. св-ва преобл.) | К1 = К2 = К3 = | |
| * - CuOH, AgOH, AuOH - неустойчивы; при попытке их получения по обменным реакциям выделяются оксиды Cu2O (красный), Ag2O (темно-коричневый), например: 2 AgNO3 (р) + 2NaOH (р) = Ag2O (т) + NaNO3 (р) + H2O(ж) | ||||
| Zn(OH)2 - гидроксид цинка | м | амфотерный гидроксид | К1 = К2 = 4 . 10-5 | |
| Cd(OH)2 - гидроксид кадмия | н | слабое основание* | К1 = К2 = 5,0. 10-3 | |
| * - амфотерные свойства Cd(OH)2 выражены очень слабо, он лишь немного растворяется в сильно концентрированных растворах щелочей Гидроксид Hg(II) неизвестен Zn(OH)2 Cd(OH)2 ® устойчивость падает Zn(OH)2, Cd(OH)2 с кислотами образуют устойчивые аквокомплексы типа [Э(ОН2)4]2+ и [Э(ОН2)6]2+ | ||||
| Sc(OH)3 - гидроксид скандия | н? | амфотерный гидроксид | К1 = К2 = 7,6 . 10-10 К3 = 7,6 . 10-10? | |
| Y(OH)3 - гидроксид иттрия | н | основной гидроксид | К1 = К2 = К3 = | |
| La(OH)3 - гидроксид лантана | н? | сильное основание | К1 = К2 = К3 = 5,2 . 10-4 | |
| Ac(OH)3 - гидроксид актиния | н? | сильное основание? | К1 = К2 = | |
| Th(OH)4 - гидроксид тория | н? | сильное основание? | К1 = К2 = К3 = К4 = 2,0 . 10-10 | |
| Sc(OH)3 Y(OH)3 La(OH)3 Ac(OH)3 ® усиливаются основные признаки и возрастает растворимость в воде Sc(OH)3 Y(OH)3 La(OH)3 - студнеобразные осадки Гидроксиды лантаноидов и актиноидов - аморфные осадки, трудно растворимые в воде; обладают основным характером и, растворяясь в кислотах, образуют соли | ||||
| Sn(OH)2 - гидроксид олова (II) | К1 = К2 = | |||
| Pb(OH)2 - гидроксид свинца (II) | н [0,0155 /100г H2O] | основной гидроксид | К1 = 9,6 . 10-4 К2 = 3,0 . 10-8 | |
| Ti(OH)2 - гидроксид титана (II)* | н | К1 = К2 = 4,3 . 10-2 | ||
| Ti(OH)3 - гидроксид титана (III) [грязно-фиолетовый осадок Ti2О3 . nН2О] | н | основной гидроксид | К1 = К2 = 4,3 . 10-2 | |
| Zr (OH)2 - гидроксид циркония | р | К1 = К2 = 4,3 . 10-2 | ||
| Hf(OH)2 - гидроксид гафния | р | К1 = К2 = 4,3 . 10-2 | ||
| * - сильный восстановитель, медленно реагирующий с водой: 2 Ti(OH)2 + 2H2O ® 2 Ti(OH)3 + H2 Гидроксиды Э (IV) - студенистые осадки переменного состава ЭО2 . nН2О; свежеприготовленные осадки (a-форма) имеют относительно большое число OH-групп, поэтому они более реакционноспособны (растворимы в кислотах), чем состарившиеся осадки (b-форма), в которых оловые группы замещены на оксоловые; гидроксиды титана (IV) растворимы в концентрированных щелочах, гидроксиды циркония (IV) и гафния (IV) с щелочами практически не взаимодействуют. | ||||
| V(OH)2 - гидроксид ванадия (II) * | н | основной гидроксид? | К1 = К2 = | |
| V(OH)3 - гидроксид ванадия (III) ** | н? | амфотерный гид-роксид (основные свойства преобл. над кислотными) | К1 = К2 = К3 = 8,3 . 10-12 | |
| V(OH)4 - гидроксид ванадия (IV) | н? | амфотерный гидроксид (кис-лотные свойства преобладают над основными) | К1 = К2 = | |
| * - осадок, легко окисляющийся на воздухе ** - гидроксид переменного состава V2О3 . nН2О | ||||
| Cr(OH)2 - гидроксид хрома (II) | р | основной гидроксид | К1 = К2 = | |
| Cr(OH)3 - гидроксид хрома (III) * | р | амфотерный гидроксид | К1 = К2 = К3 = 1,02 . 10-10 | |
| * - гидроксид переменного состава Cr2О3 . nН2О - это многоядерный слоистый полимер, в котором роль лигандов играют OH- и OH2, а роль мостиков OH-группы | ||||
| Mn(OH)2 - гидроксид марганца (II)* | амфотерный гид-роксид (основные свойства преобл. над кислотными) | К1 = К2 = 5,0 . 10-4 | ||
| Mn(OH)4 - гидроксид марганца (IV)** | кислотный гидроксид | |||
| * - легко окисляется кислородом: 2Mn(OH)2 + O2 + 2Н2О ® 2Mn(OH)4 ** - гидроксид переменного состава MnО2 . nН2О | ||||
| Fe(OH)2 - гидроксид железа (II)* | н | основной гидроксид | К1 = К2 = 1,3 . 10-4 | |
| Fe(OH)3 - гидроксид железа (III)** | н | амфотерный гид-роксид (основные свойства преобл. над кислотными) | К1 = К2 = 1,82 . 10-11 К3 = 1,35 . 10-12 | |
| *- Fe(OH)2 в момент получения тотчас начинает переходить в Fe(OH)3, поэтому белый осадок быстро темнеет: 4Fe(OH)2 + O2 + 2Н2О ®4 Fe(OH)3 бесцветный ** - гидроксид переменного состава Fe2О3 . nН2О; при его обезвоживании образуются оловые и оксоловые высокомолекулярные соединения состава FeOOH (являющиеся основой ряда минералов железа) и Fe2О3 | ||||
| Co(OH)2 - гидроксид кобальта (II) | н | амфотерный гид-роксид (основные свойства преобл. над кислотными) | К1 = К2 = 4 . 10-5 | |
| Co(OH)3 - гидроксид кобальта (III)* | основной гидроксид | |||
| * - гидроксид переменного состава Co2О3 . nН2О; амфотерные свойства выражены слабее, чем у Fe(OH)3; при слабом нагревании получаются продукты, близкие по составу к CoO(OH) Бурый Co(OH)3 получают из Co(OH)2: 2Co(OH)2 + Н2О2 ® 2Co(OH)3 розовый бурый | ||||
| Ni(OH)2 - гидроксид никеля (II)* | н | основной гидроксид | К1 = К2 = 2,5 . 10-5 | |
| Ni(OH)3 - гидроксид никеля (III)** | основной гидроксид | |||
| Pd(OH)2 - гидроксид палладия (II) | н | основной гидроксид | ||
| Pt(OH)2 - гидроксид платины (II) | н | основной гидроксид | ||
| * – имеет слоистую структуру Ni(OH)3 получают из Ni(OH)2 только действием сильных окислителей: 2Ni(OH)2¯ + Br2 +2KOН ® 2Ni(OH)3¯ + 2KBr зеленый черный | ||||
| ** – гидроксид переменного состава Ni2О3 . nН2О; амфотерные свойства выражены слабее, чем у Fe(OH)3; при слабом нагревании получаются продукты, близкие по составу к NiO(OH) | ||||
| NH4OH – гидроксид аммония | * | |||
| N2H4 – гидразин | К = 9,3 . 10-7 | |||
| N2H4 . Н2О – гидразин | К = 1,25 . 106 | |||
| NH2OH - гидроксиламин | К = 8,933 . 10-9 | |||
| NH2OH . Н2О – гидроксиламин | К = 9,33 . 10-9 | |||
| * – “истинная “ константа К = 6,3 . 10-5; “кажущаяся” константа К = 1,79 . 10-5 | ||||
ОСНОВАНИЯ - сложные вещества, в состав которых входят ионы металлов, соединенные с одной или несколькими гидроксильными группами.
С точки зрения протонной теории к основаниям относятся вещества, которые способны присоединять ионы водорода. Таким образом, к основаниям можно отнести аммиак, который способен присоединять протон с образованием иона аммония NH4+. Аммиак взаимодействует с кислотами и образует соли.
 2015-06-24
2015-06-24 8107
8107







