И.С. Колпащикова, А.Ф. Бетнев, Е.М. Алов
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Допущено учебно-методическим объединением по образованию
в области химической технологии и биотехнологии в качестве учебного
пособия для студентов высших учебных заведений, обучающихся по химико-технологическим направлениям подготовки дипломированных специалистов
Ярославль 2006
УДК 547
ББК 24.23
К 60
Колпащикова И.С., Бетнев А.Ф., Алов Е.М.
К 60 Функциональные производные углеводородов: Учебное пособие. – Ярославль: Изд-во ЯГТУ, 2006. – 136 с.
ISBN 5-230-20643-8
В пособии рассмотрены основные вопросы строения и реакционной способности, типичные реакции и основные способы получения спиртов, фенолов, карбонильных соединений, кислот, нитросоединений, аминов, диазосоединений и полифункциональных соединений.
Предназначено для студентов специальности «Химическая технология органических веществ», а также может быть рекомендовано для студентов дневной и заочной формы обучения всех специальностей химико-технологического факультета.
Ил. 5. Табл. 10. Библиогр. 5.
Рецензенты: кафедра общей и биоорганической химии Ярославского государственного университета; М.М. Кузнецов, канд. хим. наук, доцент кафедры биоорганической и биофизической химии Ярославской государственной медицинской академии.
УДК 547
ББК 24.23
______________________________________________________
Редактор Л.С. Кокина
План 2005
Подписано в печать 17.01.2006. Формат 60х84 1/16. Бумага белая.
Печать ризограф. Усл. печ. л. 7,90. Уч.-изд. л. 7,88. Тираж 450. Заказ 99
Ярославский государственный технический университет
150023, Ярославль, Московский пр., 88
Типография Ярославского государственного технического университета
150000, Ярославль, ул. Советская, 14а
_______________________________________________________
ISBN 5-230-20643-8
© Ярославский государственный технический университет, 2006
Спирты
Спиртами называются соединения с общей формулой R-OH, где R – алкильная или замещенная алкильная группа. Гидроксил -ОН является функциональной группой и определяет свойства, характерные для спиртов. По числу функциональных групп в молекуле различают одно-, двух- и многоатомные спирты. R-OH – одноатомный спирт. Спирты классифицируют как первичные, вторичные и третичные:

По строению углеродного радикала различают насыщенные, ненасыщенные и ароматические спирты.
Номенклатура. По номенклатуре IUPAC насыщенные спирты называют алканолами.
В соответствии с заместительной номенклатурой название спирта строят следующим образом:
1) выбирается наиболее длинная углеродная цепь, содержащая гидроксильную группу;
2) эта цепь нумеруется с того конца, к которому ближе гидроксильная группа;
3) называют соответствующий углеводород с добавлением окончания - ол и указанием номера углерода, при котором находится гидроксил;
4) наименования всех оставшихся групп являются префиксами и располагаются в алфавитном порядке.
Пример:
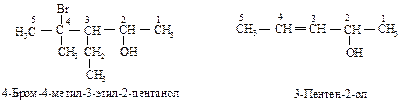
В соответствии с радикально-функциональной номенклатурой название спиртов составляется из названия радикала и слова спирт.

1.1. Физические свойства
При нормальных условиях спирты до С10 - жидкости, начиная с С11 и далее - твердые тела.
При сравнении физических свойств низших спиртов, в которых полярная группа -ОН составляет значительную часть молекулы, со свойствами углеводородов с близкой молекулярной массой обнаруживаются резкие различия: спирты имеют более высокие температуры кипения, плавления и растворимость в воде (табл. 1.).
Таблица 1
Сравнение физических свойств спиртов и углеводородов
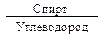 | Молекулярная масса | Тпл., оС | Ткип., оС | Растворимость в 100 мл воды, мл |
| СН3ОН СН3-СН3 | -98 -172 | -89 | Неограниченная 4,7 | |
| СН3СН2ОН СН3СН2СН3 | -117,3 -189,9 | 78,5 -42,2 | Неограниченная 6,5 | |
| СН3СН2СН2ОН СН3СН2СН2CН3 | -127 -135 | 97,2 -0,6 | Неограниченная |
Все указанные особенности спиртов объясняются наличием водородных связей. Водородной называетсясвязь, обусловленная электростатическим притяжением между протонированным водородом одной молекулы и электроотрицательным атомом второй молекулы. Для образования водородной связи необходимо, чтобы электроотрицательными атомами были O, N, F. С одной стороны, электроотрицательные элементы концентрируют на своих маленьких атомах отрицательные заряды и, с другой стороны, водород, связанный ковалентной связью с любым из этих атомов, становится достаточно протонированным. Молярная энергия такой электростатической связи около 20·103 Дж/моль.
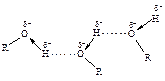
Спирт является ассоциированной жидкостью. Более высокие температуры кипения спиртов по сравнению с температурами кипения соответствующих углеводородов обусловлены необходимостью разрыва водородных связей при переходе молекул в газовую фазу, для чего необходима дополнительная энергия.
Растворимость низших спиртов в воде обусловлена образованием водородных связей между молекулой спирта и молекулой воды.
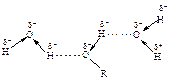
С увеличением углеродной цепи вклад гидроксильной группы в молекулярную массу спирта уменьшается, и соответственно уменьшается растворимость в воде. Начиная с С8, спирты практически не растворяются в воде.
Физические свойства высших спиртов оказываются сходными со свойствами углеводородов с близкой молекулярной массой. Спирты нормального строения кипят при более высокой температуре, чем спирты с той же молекулярной массой с разветвленной цепью. При одинаковом количестве атомов углерода первичные спирты кипят при более высокой температуре, чем вторичные и третичные спирты. Температура кипения возрастает с увеличением длины цепочки.
 2015-06-24
2015-06-24 2611
2611







