| Ряды | Примеры кислот | Формула |
| Двухосновные (дикарбоновые) | щавелевая | НООС – СООН |
| Малоновая | НООС – СН2 – СООН | |
| Янтарная | НООС – (СН2)2 – СООН | |
| Глутаровая | НООС – (СН2)3 – СООН | |
| Одноосновные непредельные | Акриловая | СН2=СН – СООН |
| Метакриловая | СН2=С(СН3) – СООН | |
| Олеиновая | С8Н17СН=СН(СН2)7 – СООН | |
| Линолевая | С17Н31СООН | |
| Линоленовая | С17Н29СООН | |
| Ароматические | Бензойная | С6Н5 – СООН |
| Фталевые | С6Н4 – (СООН)2 |
Некоторые двухосновные и непредельные кислоты значительно сильнее, чем уксусная кислота и ее гомологи. Из кислот самая сильная – щавелевая кислота. Двойные связи карбоксильных групп здесь сопряжены, и этим обеспечивается более сильная делокализация отрицательного заряда в остатке кислоты после диссоциации иона водорода.
Первые члены гомологических рядов кислот хорошо растворимы в воде. Некоторые кислоты (уксусная, муравьиная) неограниченно смешиваются с водой. Уксусную кислоту используют для консервирования пищевых продуктов и как приправу. Но это не означает, что органическая кислота безвредна и безопасна. Безводная(«ледяная») уксусная кислота при попадании но кожный покров быстро проникает вглубь и оставляет на коже долго незаживающие язвы. Она опаснее, чем серная кислота.
Карбоксильная группа образует водородные связи не только с водой, но и с другой карбоксильной группой:
// O – H – O \
R – C C – R
\ O – H – O //
При переходе к высшим членам гомологических рядов растворимость кислот постепенно уменьшается и появляется свойство поверхностной активности.
Получение. Изучая свойства углеводородов и альдегидов, мы уже узнали некоторые реакции образования кислот. Это каталитическое окисление бутана, окисление алкинов и альдегидов.
В мире ежегодно производится до 4 млн т уксусной кислоты. В этом производстве наибольшее значение имеет окисление бутана (и пентана) и ацетальдегида. Пищевую уксусную кислоту получают уксуснокислым брожением этанола.
Натриевая соль муравьиной кислоты получается из неорганических веществ:
p, t
CO + NaOH = HCOONa
Затем выделяют муравьиную кислоту перегонкой с H2SO4. При наличии готовых солей из них получают и другие кислоты.
Общим методом получения кислот является оксосинтез- присоединение оксида углерода (II) к спиртам в присутствии кобальта:
Co
R – OH + CO = R – COOH
Уже известные нам реактивы Гриньяра могут быть применены и для получения кислот:
эфир
 R – MgI + CO2 = R – COOMgI H+ R – COOH
R – MgI + CO2 = R – COOMgI H+ R – COOH
Высшие карбоновые кислоты получают гидролизом жиров.
Химические свойства. Карбоновые кислоты обратимо диссоциируют в растворах и проявляют все общие свойства кислот. В реакциях с основаниями, основными оксидами, карбонатами и подобными им солями образуются соли карбоновых кислот. Соли низших членов гомологических рядов представляют собой кристаллические вещества, растворимые в воде. У солей гексановой и следующих за ней кислот появляется свойство поверхностной активности. Кроме того, длины углеводородный радикал препятствуют кристаллизации вещества, и оно оказывается в особом состоянии, известном как мыло. В нем имеются двойные слои, объединяющие солевые группы – СООМ (М=Na+, K+) и углеводородные радикалы.
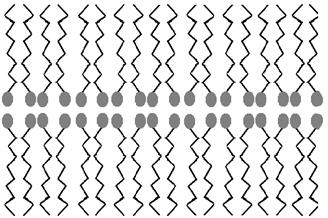 Двойные слои (мицеллы) мыла.
Двойные слои (мицеллы) мыла.
О

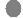 – солевая группа – С – М+
– солевая группа – С – М+
О
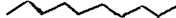 – углеводородный радикал
– углеводородный радикал
Соли органических кислот имеют названия, часто не совпадающие с русскими названиями кислот:
| Кислота | Название солей |
| Муравьиная | Формиаты |
| Уксусная | Ацетаты |
| Пропионовая | Пропионаты |
| Масляная | Бутриаты |
| Щавелевая | Оксалаты |
| Янтарная | Сукцинаты |
Ионы многоосновных органических кислот и металлов с зарядом +2 и более образуют комплексные соединения:
3K2C2O4 + FeCl3 = K3[Fe(C2O4)3] + 3KCl
Это вещество выделяется из насыщенного раствора в виде салатно-зеленых кристаллов, темнеющих под действием света.
Муравьиная и щавелевая кислоты отличаются от других карбоновых кислот отсутствием углеводородных радикалов. Они проявляют восстановительные свойства:
HCOOH + 2[Ag(NH3)2]OH = NH4HCO3 + 2Ag + 3NH3 + H2O
5H2C2O4 +2 KMnO4+ H2SO4 = 10CO2 + 2 MnSO4 + 8 H2O +K2SO4
Муравьиная кислота неустойчива сама по себе и медленно разлагается по реакции 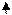 :
:
HCOOH = CO + H2O
В присутствии концентрированной серной кислоты эта реакция идет быстро и применяется для получения оксида углерода в лаборатории.
Радикалы карбоновых кислот также могут участвовать в химических реакциях. В радикалах предельных кислот наиболее реакционноспособен углеродный атом, связанный с карбоксильной группой, или а-углерод. Хлор или бром замещают водород в а-положении в присутствии красного фосфора:
CH3 – CH2 – COOH + Br2 = CH3 – CH – COOH + HBr
I
Br
Галогензамещенные кислоты проявляют более сильные кислотные свойства, чем исходные карбоновые кислоты, например:
СН3СООН < CH2ClCOOH < CHCl2COOH < CCl3COOH
Реакции нуклеофильного замещения SN . Карбоновые кислоты реагируют со спиртами в присутствии сильной кислоты (H2SO4):
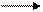 R–COOH + R’–OH R–COO–R’ + H2O
R–COOH + R’–OH R–COO–R’ + H2O
Это реакция этерификации, продуктами которой являются сложные эфиры – летучие вещества, чатто имеющие приятный запах. Их применяют в качестве эссенции в пищевой промышленности. Так, сложный эфир масляной кислоты и этанола (этилбутират) имеет запах ананаса, а еще лучше сказать- придает ананасу запах ананс. Используются разные системы названии сложных эфиров. По систематической номенклатуре они составляются подобно названию соли с обозначением углеводородного радикала R, в виде приставки. По традиционной системе берутся названия кислоты и спирта с добавлением слова эфир.
Общие формулы гомологических рядов сложных эфиров и карбоновых кислот совпадают. Поэтому при одинаковом числе атомов углерода кислота и сложный эфир оказываются изомерами. Так, этилацетат и масляная кислота - изомеры с формулой C4H8O2. На этой паре веществ можно сравнить летучесть кислот и эфиров:
Этилацетат Масляная кислота
СН3СООС2Н5 С3Н7СООН
t кип = 77,1 ` C t кип = 163,5 ` C
Своей летучестью сложные эфиры похожи на простые эфиры. Поэтому оба класса веществ и получили близкие названия. Но сложные эфиры отличаются более выраженной обратимостью реакции этерификации и быстрым гидролизом в присутствии щелочи. Реакцию сложного эфира со щелочью называют омылением.
СН3СООС2Н5 + NaOH = CH3COONa + C2H5OH
Этерификация может приводить к образованию полимеров, называемых полиэфирами. Для получения полиэфира берут двухосновную кислоту и двухатомный спирт. Большое распространение получил полимер n –фталевой (терефталевой) кислоты с этиленгликолем:
НОСН2СН2О – Н + НО – ОСС6Н4СО – ОН + Н – ОСН2СН2ОН + …= НОСН2СН2О - ОС6Н4СО – ОСН2СН2О – +…+ 2Н2О
Волокно, изготовленное на его основе, называют лавсаном. *Лавсан – сокращение от «лаборатория высокомолекулярных соединений академии наук»
Исследователей интересовал вопрос: в каком веществе идёт замещение гидроксильной группы при этерификации – в кислоте или спирте? Это удалось установить, когда был поставлен опыт по этерификации кислоты спиртом, обогащенным стабильным изотопом кислорода 18О:
СН3СООН + С2Н518ОН = СН3СО18ОС2Н5 + Н2О
СЛОЖНЫЙ ЭФИР
Оказалось, что «меченый» атом кислорода переходит в состав эфира. Очевидно, что гидроксильная группа замещается в кислоте. Таким образом, этерификация – это реакция нуклеофильного замещения на углероде карбоксильной группы:
/ O / Н
 R – C + Н+ +:О
R – C + Н+ +:О
\ ОН \ R’
кислота катализатор спирт
 Н – О \ / Н
Н – О \ / Н
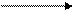 С+ +:О
С+ +:О
R / \ OH \ R’
Н–О\ / О \ –R’ / O– R’

 С H R – C + H+ + H2O
С H R – C + H+ + H2O
R / \ OH \ \ O
сложный эфир
Сложные эфиры относят к функциональным производным карбоновых кислот. Ещё две разновидности функциональных производных получаются при реакциях карбоновых кислот с галогенидами и оксидом фосфора (V). В обоих случаях в карбоксильной группе замещается гидроксил:
/ / O / / O
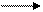 R – C + PCl5 R – C + POCl3 + HCl
R – C + PCl5 R – C + POCl3 + HCl
\ O \ Cl
/ / O
/ / O R – C \
 2R – C + P2O5 / O + 2HPO3
2R – C + P2O5 / O + 2HPO3
\ O R – C
\ \ O
Ангидриды и галогенангидриды – очень реакционноспособные вещества, позволяющие ацилировать разнообразные молекулы, т.е. вводить и в ацил. Взяв этилат натрия и ацетилхлорид (хлорангидрид уксусной кислоты), получим сложный эфир:
С2Н5ОNa + CH3CO – Cl = CH3CO – OC2H5 + NaCl
При реакции хлорангидридов кислит с аммиаком получается ещё одна разновидность функциональных производных – амиды кислот:

 2015-06-26
2015-06-26 1749
1749
