Физические свойства
a-Аминокислоты – кристаллические вещества белого или сероватого цвета. Они хорошо растворяются в воде с образованием электролитов, плохо – в спирте, не растворяются в эфире. Аминокислоты в твердом и растворенном состоянии имеют биполярное строение, на что указывает отсутствие в ИК-спектрах отдельных полос поглощения, характерных для – NН2 и –СООН групп, они обладают высокой температурой плавления (См. Приложение 3).
Амфотерность
– способность a- аминокислот диссоциировать в водном растворе по типу кислоты и основания из-за наличия в их составе групп кислотного (-СООН) и основного (-NH2) характера. Аминокислоты существует в виде равновесной смеси биполярного иона (цвиттериона) катионной и анионнойформ, равновесие которых зависит от рН среды:
+H+ +OH–
 NH3+ – СH – COOH NH3+ – CH – COO– NH2 – CH – COO– + H2O
NH3+ – СH – COOH NH3+ – CH – COO– NH2 – CH – COO– + H2O
ï – H+ ï – OH– ï
R R R
Катионная форма Биполярный ион Анионная форма
Сильнокислая среда Сильнощелочная среда
 рН 1,0 рН 7,0 рН 11,0
рН 1,0 рН 7,0 рН 11,0
Катионные формы пребладают в сильнокислых средах, анионные - в сильнощелочных. Катионная форма a-аминокислоты, с позиций теории Бренстеда, является двухосновной кислотой, содержащей две кислотные группы: недиссоциированную карбоксильную группу и протонированную аминогруппу. Характеризуется кислота соответствующими значениями рКа1 и рКа2. Отдавая один протон, двухосновная кислота превращается в слабую одноосновную - диполярный ион с одной кислотной +NH3 -группой. Депротонирование диполярного иона приводит к получению анионной формы a-аминокислоты - карбоксилат-аниона (основание Бренстеда).
Значения рКа1, характеризующие кислотные свойства – СООН группы a-аминокислот, лежат в интервале от 1 до 3; значения рКа2, характеризующие кислотность аммониевой группы, - от 9 до 10. Положение равновесия (соотношение различных форм a-аминокислоты) в водном растворе при определенных значениях рН зависит от наличия в радикале R ионогенных групп, которые играют роль дополнительных кислотных и основных центров.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм a-аминокислоты равны, называется изоэлектрической точкой (pI).
pI = 1/2 . (рКа n + рКа n+1),где
n - максимальное число положительных зарядов в протонированной a-аминокислоте
В изоэлектрической точке суммарный заряд молекулы a-аминокислоты равен нулю. Биполярные ионы не перемещаются в электрическом поле. При значениях рН ниже рI катион a-аминокислоты (аммониевая форма) движется к катоду; при рН выше, чем pI, карбоксилат-анион аминокислоты перемещается к аноду. На этом основано разделение аминокислот методом электрофореза.
Нейтральные а-аминокислоты имеют рI несколько ниже 7,0 (5,5—6,3) из-за большей ионизации карбоксильной группы под влиянием -Iэфф +NH3 –группы:
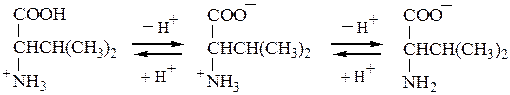
катион биполярный ион анион
pKa 1 = 2,3 СOOH-группы pI = 6,0 рКа2 = 9,6 +NH3-группы
Кислые а-аминокислоты, имеющие в радикале дополнительную карбоксильную группу, в сильнокислой среде находятся в полностью протонированной форме. Они являются трехосновными кислотами (по Бренстеду), характеризующимися тремя значениями рКа, как это видно на примере глутаминовой кислоты (рI = 3,2):
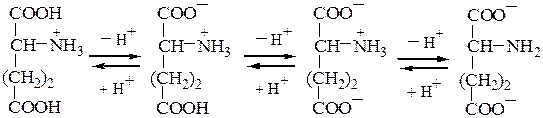
катион биполярный ион анион дианион
рКа1= 2,2 (a-СOOH) pI=3,2 pKa2=4,3 (COOH в pKa3=9,7 +NH3- радикале группы
Основные а-аминокислоты имеют изоэлектрическую точку выше рН 7. В сильнокислой среде они также представляют собой трехосновные кислоты, этапы ионизации которых выглядят следующим образом:
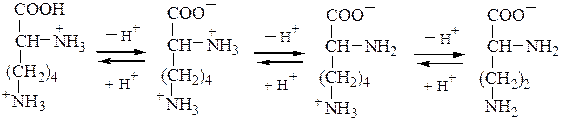
Дикатион катион биполярный ион анион
лизина pKa1=2,2 (COOH) pKa2=9,0 (a-+NH3) pKa3=10,5 (+NH3 в радикале)
Свойство аминокислот диссоциировать на ионы в кислой или щелочной среде лежит в основе методов разделения и идентификации их ионообменной хроматографией и электрофорезом (см. главу 6).
 2014-02-03
2014-02-03 8857
8857
