| Определение
| • учение о скорости протекания химической реакции и зависимости скорости от различных факторов (состава реакционной массы, концентрации реагирующих веществ, температуры, наличия катализаторов и т. п.)
|
| Средняя скорость химической реакции,
U (моль/ (л ∙ с);
моль/ (м3 ∙ с);
моль/(м3 ∙ мин)и т.п.)
| • определяется, как отношение изменения концентраций некоторого компонента системы (∆C) к интервалу времени (∆τ) за который это изменение произошло средняя – за некоторый промежуток времени:
∆C С2 – С1
V= ± —— или V= ± ———,
∆τ τ 2 – τ 1
где:
С1, С2 – начальная и конечная концентрация участников реакции,
τ1, τ2 – моменты времени соответствующие начальной и конечной концентрациям участников реакции
|
| Факторы, влияющие на скорость реакции
| • природа реагентов, концентрация реагентов, температура системы, присутствие катализаторов, давление (при наличии газовых компонентов), электромагнитное излучение, механическое воздействие и т.п.
|
| Закон действующих масс
| • при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагентов, с учетом стехиометрических коэффицентов как показателей степени;
впервые установили Гульдберг и Вааге (1867г.);
пример: 2NO + H2 = N2O + H2O
V = k C2(NO) ∙ C (H2)
|
| Константа скорости реакции, k
| • величина, численно равная скорости реакции, при концентрации каждого из исходных веществ равной единице
|
| Молекуляр-ность реакции
| • определяется числом молекул, одновременным взаимодействием между которыми осуществляется акт химического превращения. Могут быть одномолекулярные (мономолекулярные) J2= 2J реакции, двухмолекулярные (бимолекулярные) CO2(г)+C(к)=2CO(г) и трехмолекулярные (тримолекулярные) 2NO + H2 = N2O + H2O;
в случае гетерогенных реакций в уравнение
входят концентрации только тех веществ, концентрация которых может изменяться; как правило, это вещества в газовой фазе или растворе; концентрации веществ, находящихся в твердой фазе (но не в сплавах и твердых растворах) представляют собою постоянную величину и в выражение для расчета скорости не включаются
|
| Порядок
реакции
| • равен сумме показателей степени концентрации веществ в уравнении, выражающем закон действующих масс:
U = k Cа (A) Cb (В) − порядок реакции − a+b
|
| Правило Вант-Гоффа
| • при повышении температуры реакционной смеси на каждые 10 0 скорость реакции увеличивается в 2-4 раза
t2 –t1
10
U = U 0 γ
γ = 2÷4 − температурный коэффициент реакции
|
| Влияние температуры на скорость реакции
| • увеличение температуры, как правило, приводит к резкому увеличению скорости химической реакции;
пример:
при t0 < 300 0С реакция 2H2 + O2 = 2H2O идет с
неизмеримо малой скоростью, при 700о С − взрывообразно
|
| Энергия активации, Ea(кДж/моль)
| • наименьшая энергия, которой должны обладать частицы, чтобы их столкновение приводило к взаимодействию между ними, т.е. – к химической реакции
|
| Уравнениие Аррениуса
| • связывает константу скорости k реакции с энергией активации Ea
k = A exp (- Ea/ RT)
где А – постоянный для данной системы предъэкспоненциальный множитель;
R= 8,314 Дж/(моль · К) – универсальная газовая постоянная, T– абсолютная температура
|
| Обратимые реакции
| • химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями; например: N2 + 3H2 ó 2NH3
|
| Химическое равновесие
| • состояние химической системы при постоянной температуре, в котором, в результате протекания обратимых реакций наблюдается динамическое равновесие между исходными веществами и продуктами реакции, т. е., концентрация всех компонентов системы не изменяется со временем;
• условие наступления равновесия
– равенство скоростей прямой и обратной реакций
|
| Константа равновесия,
К
| • количественная характеристика химического равновесия, характеризующая степень превращения исходных веществ в продукты реакции.
Для реации:
аА+вВ ó сС+dD 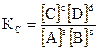 ,
где квадратными скобками обозначены равновесные концентрации компонентов;
• cхема рекции:
aA + bB = dD + fF
а) если реакционная система содержит газообразные компоненты, то константа равновесия может быть выражена через их парциальные давления:
pd(D)∙pf (F)
Kp = ——————;
pa (А)∙ pb (B)
если К>1, то концентрация продуктов реакции при равновесии выше концентрации исходных веществ;
если К<1, концентрация продуктов реакции при равновесии меьше концентрации исходных веществ ,
где квадратными скобками обозначены равновесные концентрации компонентов;
• cхема рекции:
aA + bB = dD + fF
а) если реакционная система содержит газообразные компоненты, то константа равновесия может быть выражена через их парциальные давления:
pd(D)∙pf (F)
Kp = ——————;
pa (А)∙ pb (B)
если К>1, то концентрация продуктов реакции при равновесии выше концентрации исходных веществ;
если К<1, концентрация продуктов реакции при равновесии меьше концентрации исходных веществ
|
| Принцип Ле-Шателье
| •если находящаяся в равновесии система подвергается внешнему воздействию (изменяется температура, давление, концентрация компонентов), то равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия
|
| Действие принципа Ле-Шателье
| • увеличение температуры способствует смещению равновесия в сторону эндотермической реакции, уменьшение температуры – в сторону экзотермической реакции;
увеличение давления в системах, содержащих газовую фазу, смещает равновесие в сторону меньшего количества газообразного вещества; уменьшение давления – в сторону большего количества вещества;
увеличение концентрации одного из реагентов вызывает сдвиг равновесия в направлении расходования этого компонента;
пример:
для реакции 2SO3 ó 2SO2+O2; ΔН0 = 198 кДж
увеличение концентрации SO2 смещает равновесие влево (в сторону исходных веществ);
повышение температуры для эндотермической реакции смещает равновесие вправо (в сторону продуктов реакции);
повышение давления смещает равновесие влево (количество вещества газообразных компонентов, стоящих в левой части уравнения меньше, чем в правой)
|
| Катализ
| • (от греческого katalysis – разрушение), явление изменения скорости реакции или ее возбуждения, происходящее под действием определенных веществ - катализаторов
|
| Катализатор
| • вещество, изменяющее скорость химической реакции, но в результате реакции остающееся без химических изменений
- положительные катализаторы ускоряют химическую реакцию
- отрицательные катализаторы (ингибиторы) замедляют химическую реакцию
|
| Гомогенный катализ
| • катализатор находится в одной однородной газовой или жидкой фазе с реагирующими соединениями
|
| Гетерогенный катализ
| • катализатор находится в разных фазах с реагирующими соединениями, взаимодействие происходит на поверхности раздела фаз
|
| Автокатали-тические реакции (самоуско-ряющиеся)
| • каталитически ускоряются продуктами реакции
|
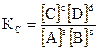 ,
где квадратными скобками обозначены равновесные концентрации компонентов;
• cхема рекции:
aA + bB = dD + fF
а) если реакционная система содержит газообразные компоненты, то константа равновесия может быть выражена через их парциальные давления:
pd(D)∙pf (F)
Kp = ——————;
pa (А)∙ pb (B)
если К>1, то концентрация продуктов реакции при равновесии выше концентрации исходных веществ;
если К<1, концентрация продуктов реакции при равновесии меьше концентрации исходных веществ
,
где квадратными скобками обозначены равновесные концентрации компонентов;
• cхема рекции:
aA + bB = dD + fF
а) если реакционная система содержит газообразные компоненты, то константа равновесия может быть выражена через их парциальные давления:
pd(D)∙pf (F)
Kp = ——————;
pa (А)∙ pb (B)
если К>1, то концентрация продуктов реакции при равновесии выше концентрации исходных веществ;
если К<1, концентрация продуктов реакции при равновесии меьше концентрации исходных веществ
 2015-06-26
2015-06-26 479
479








