ФЕРМЕНТЫ
Ферменты - катализаторы белковой природы, которые ускоряют химические реакции в живой клетке в миллиарды (1010) раз.
Свойства ферментов-биокатализаторов
Общие с неорганическими катализаторами
1. малые количества
2. не входят в состав продуктов реакции
3. не расходуются в процессе реакции
4. не катализируют реакции, которые противоречат законам термодинамики
5. увеличивают скорость протекания реакции
Отличия от неорганических катализаторов
1. ферменты - белки(обладают всеми свойствами белков имеют оптимальные значения рН, температуры, подвергаются денатурации)
2. избирательность (специфичность)
3. регулируемость
4. скорость ферментативных реакций значительно выше
Строение ферментов
 Сложные (холофермент) Простые
Сложные (холофермент) Простые
белковая часть небелковая часть только белковая часть

 (апофермент) кофактор кофермент простетическая группа
(апофермент) кофактор кофермент простетическая группа
 ионы Ме органическая молекула
ионы Ме органическая молекула
Мg, Fе, Zn непрочно связана прочно связана
входят в с акт. центром с акт. центром
акт. центр НАД липоевая кислота
Действие фермента определяется его белковой частью.
Активный центр – часть белковой молекулы фермента, образующая «нишу» (углубление), где происходит взаимодействие фермента и субстрата, и в результате биохимической реакции образуется продукт реакции.
Активный центр формируют функционально активные группы аминокислотных остатков: тир-ОН, сер-ОН, цис-SН, лиз-NН2, глу-СООН, гис-N.
 Активный центр ацетилхолинэстеразы АХЭ состоит издвух функционально важных и пространственно разделенных участков: 1-связывающий участок, куда входит СОО- группа, электростатически взаимодействующая с N+ субстрата и 2-каталитический, ответственный за эстеразную активность, куда входят тир-ОН, сер-ОН и гис-N
Активный центр ацетилхолинэстеразы АХЭ состоит издвух функционально важных и пространственно разделенных участков: 1-связывающий участок, куда входит СОО- группа, электростатически взаимодействующая с N+ субстрата и 2-каталитический, ответственный за эстеразную активность, куда входят тир-ОН, сер-ОН и гис-N
 тир АХЭ
тир АХЭ

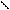
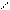
 СН3 СН3 ОН ацетилхолин холин + уксусная кислота
СН3 СН3 ОН ацетилхолин холин + уксусная кислота
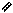

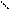 СН3 N – СН2-СН2 - О О Н2О
СН3 N – СН2-СН2 - О О Н2О
 _+ С ОН сер
_+ С ОН сер

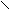 СОО СН3
СОО СН3
 N
N
гис
Аллостерический центр (регуляторный) – участок белковой молекулы, с которым взаимодействует активатор или ингибитор, находится в другой субъединице.
Активность фермента - количественная характеристика действия фермента, т.е. скорость ферментативной реакции (т.к. определить количество самого фермента практически невозможно)
Активность фермента определяется по изменению количества или субстрата или продукта.
1 МЕ (международная единица) – такое количество фермента, которое катализирует превращение одного моля субстрата за 1 мин в стандартных условиях.
 2015-06-26
2015-06-26 356
356







