Ферменты
Катализаторы – это вещества, ускоряющие химические реакции; в ходе реакции они претерпевают физические изменения, но по ее завершении возвращаются в исходное состояние. Ферменты являются белковыми катализаторами биохимических реакций, большая часть которых в отсутствие ферментов протекала бы крайне медленно. В отличие от небелковых катализаторов (Н+,ОН-, ионы металлов) каждый фермент способен катализировать лишь очень небольшое число реакций, часто только одну. Таким образом, ферменты представляют собой реакционно-специфические катализаторы. Практически все
Биохимические реакции катализируются ферментами.
Схема процесса катализа: Е + S ↔ ES ↔ EP → E + P
Е – фермент;
S (субстрат) – лиганд, взаимодействующий с активным центром фермента;
Р – продукт реакции.
Свойства ферментов
- Специфичность.
- Каталитическая эффективность.
- Лабильность ферментов.
- Способность ферментов к регуляции.
- Высокий коэффициент полезного действия (100 %).
Строение активного центра фермента
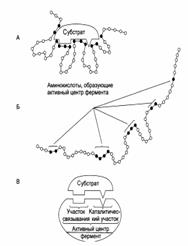 | А – присоединение субстрата к ферменту в активном центре. Б – положение аминокислотных остатков, формирующих активный центр фермента в первичной структуре белка. В – активный центр фермента условно разделяется на участок связывания и каталитический участок. Участок связывания представлен радикалами аминокислот, функциональные группы которых обеспечивают связывание субстрата. Каталитический участок образован радикалами аминокислотных остатков, функциональные группы которых обеспечивают химические превращения субстрата. |
 2015-06-26
2015-06-26 1032
1032