Схема уровней и основные серии спектра атомов(ионов) с одним валентным электроном (на примере К 19).
19К: 1s22s22p63s23p64s1
4s1=> n=4, l=0 => L=0
s=1/2 => S=1/2 2s+1=2
основной терм: 42S1\2
составим таблицу:
| n | l | j | терм |
| 1/2 | 2S1\2 | ||
| 3/2 | 2P3\2 | ||
| 1/2 | 2P1\2 | ||
| 5/2 | 2D5\2 | ||
| 3/2 | 2D3\2 | ||
| 7/2 | 2F7\2 | ||
| 5/2 | 2F5\2 |
| n | l | j | терм |
| 1/2 | 2S1\2 | ||
| 3/2 | 2P3\2 | ||
| ½ | 2P1\2 | ||
| 5/2 | 2D5\2 | ||
| 3/2 | 2D3\2 | ||
| 7/2 | 2F7\2 | ||
| 5/2 | 2F5\2 | ||
| 9/2 | 2G9\2 | ||
| 7/2 | 2G7\2 |
n=4, l=3 => L=3
J=7/2, 5/2
Главная серия спектра (переход из возбужденных Р термов на оси S терм)
ν1=4S1\2-n2P1\2
ν1=4S1\2-n2P3\2 n=4,5,6
2-ая побочная серия (переход с возбужд. S –термов на первые возбужд. Р термы)
ν1=42P1\2-n2S1\2
ν1=42P1\2-n2S3\2 n=5,6
Δ ν -расстояние м/у линиями=const, а расстояние м/у 2-ми линиями (ν гр-второй потенциал ионизации)
1-ая побочная серия (переход между P4D термами)
ν1=42P1\2-n2D3\2 ΔJ=1
ν1=42P3\2-n2D3\2ΔJ=0 n=4,5
ν1=42P3\2-n2D5\2ΔJ=1
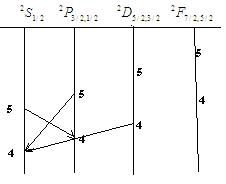
Схема уровней и основные серии спектра атомов(ионов) с двумя валентными электронами (одноэлектронное возбуждение на примере Hg)
4f145d106s2
| Собст. значения e | L | Синглет. термы | Триплетные термы | ||||||
| J | терм | J | терм | ||||||
| 6S | 7S | 1S0 | 3S1 | ||||||
| S | P | 1P1 | 2,1,0 | 3P2,1,0 | |||||
| S | D | 1D2 | 3,2,1 | 3D3,2,1 | |||||
| S | F | 1F3 | 4,3,2 | 3F4,3,2 | |||||
Главная серия:
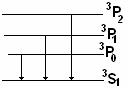
ν1=63S1-63P0
ν2=63S1-63P1
ν3=63S1-63P2
Соотношение интенсивностей между линиями будет определяться соотношение статистических весов P-термов
2 Побочная серия:

ν1=63P0-73S1
ν2=63P1-73S1
ν3=63P2-73S1
1 Побочная серия:
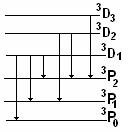
ν1=63P0-63D1
ν2=63P1-63D1
ν3=63P2-63D1
ν4=63P1-63D2
ν5=63P2-63D2
ν6=63P2-63D3
 2015-06-26
2015-06-26 721
721







