Электрохимические процессы по механизму протекания отличаются от химических процессов тем, что процессы окисления и восстановления в них пространственно разделены друг от друга. Электрохимические процессы протекают в электрохимических ячейках, которые можно разделить на два типа: гальванический элемент или электрохимический источник тока и электролизёр или электролитическая ванна.
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов. 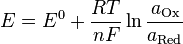 , где
, где
· 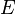 — электродный потенциал,
— электродный потенциал, 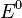 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
· 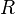 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
· 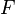 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 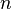 — число электронов, участвующих в процессе;
— число электронов, участвующих в процессе;
· 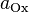 и
и 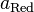 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 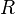 и
и 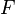 и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 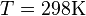 получим
получим
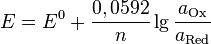
 2015-07-04
2015-07-04 2184
2184

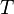 —
— 






