Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
|
|
|
Измерение потенциалов
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Потенциалы изучаемых электродов могут быть как больше, так и меньше потенциала стандартного водородного электрода, они могут иметь по водородной шкале как положительное, так и отрицательный знак. О знаке потенциала судят по направлению движения электронов в цепи гальванического элемента.
Если в гальванической цепи движение электронов происходит от водородного электрода к измеряемому (Ме) электроду, то потенциал исследуемого электрода > 0 (водород является восстановителем). В элементе
(Pt) Н2/Н+ 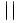 Cu2+/Cu
Cu2+/Cu
| Eo2H /H2 | 0;ECuo | 2 /Cu | 0,34B. |
восстанавливаются ионы меди и окисляется водород.
Если движение электронов происходит от металлического электрода к стандартному водородному электроду, то потенциал исследуемого электрода
EoMen /Me < 0 (ионы водорода являются окислителем). В элементе
(Pt) H2/H+ 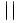 Zn2+/Zn
Zn2+/Zn
окисляется цинк и восстанавливается ионы Н+.
 2015-07-04
2015-07-04 3390
3390
