Для определения электродных потенциалов собирают гальванический элемент, состоящий из электрода, потенциал которого нас интересует, и стандартного водородного электрода, а затем измеряют ЭДС данного элемента.
Стандартный водородный электрод, потенциал которого принят равным нулю и который всегда должен быть левым относительно другого электрода, записывается следующим образом:
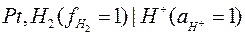
Определим потенциал цинкового электрода. Цинковый электрод записывается в виде:
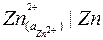
Потенциал этого электрода определяется электродвижущей силой элемента.
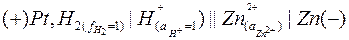
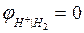
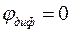
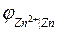
Опыт показывает, что при работе элемента цинк окисляется: 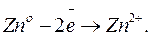 Значит, потенциалу цинкового электорода должен быть приписан отрицательный знак. Абсолютная величина цинкового электрода равна:
Значит, потенциалу цинкового электорода должен быть приписан отрицательный знак. Абсолютная величина цинкового электрода равна:
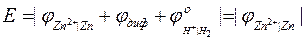
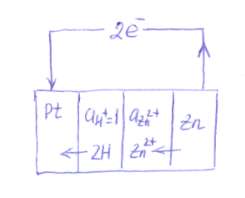
Так как заряд цинка отрицательнее заряда платины, электроны будут переходить от цинка к платине, т.е. справа налево. В этом же направлении — и это характерно для отрицательного электрода, находящегося в паре со стандартным водородным электродом — будут переходить и катионы в соответствующих растворах элемента.
В отличие от цинкового электрода медный электрод имеет положительный потенциал, соответствующий положительной ЭДС элемента:
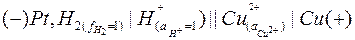
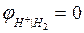
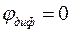
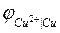
Здесь в медном электроде самопроизвольно идет восстановительная реакция: 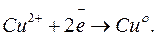
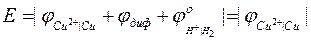
ЭДС данного элемента будет равна потенциалу медного электрода.
При активностях ионов меди и цинка, равных единице, ЭДС соответствующих элементов определяют стандартные потенциалы медного и цинкового электродов.
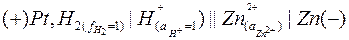
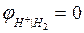
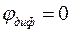
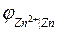
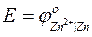 — стандартный электродный потенциал цинкового электрода.
— стандартный электродный потенциал цинкового электрода.
Стандартный электродные потенциалы образуют ряд, который применительно к системам металл — ионыметалла в водном растворе соответствует расположению металлов по их химической активности, т.е. ряду напряжений:
| Электрод | 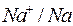
| 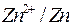
| 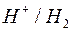
| 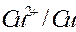
| 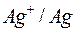
|
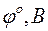
| -2,713 | -0,763 | 0,00 | 0,337 | 0,799 |
Разность потенциалов двух электродов в водородной шкале ЭДС элемента, составленного из этих электродов, и включает два электродных скачка потенциала на границе металл — раствор электролита и скачок потенциала на границе металл — металл, если диффузионный потенциал раствор — раствор пренебрежимо мал.
Хотя водородный электрод при правильной работе дает очень точные результаты, воспроизводимые до 10-5 В, но работать с ним достаточно неудобно, т.к. он весьма чувствителен к чистоте используемого водорода и к состоянию поверхности платины. Поэтому в настоящее время при экспериментальном измерении потенциалов электродов используют электроды II рода: каломельные или хлорсеребряный. Эти электроды обладают постоянным значением потенциала, которые приводятся в таблицах, и их называют электродами сравнения.
 2015-05-10
2015-05-10 534
534








