А. Способи добування
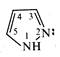 У природі піразол (1,2-діазол) та його похідні не зустрічаються.
У природі піразол (1,2-діазол) та його похідні не зустрічаються.
З методів синтезу найважливішими є:
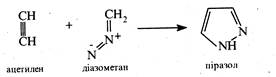
1. Приєднання діазоалканів до ацетиленів. Реакцію використовують для добування піразолу та його похідних. Піразол за цією реакцією добувають приєднанням діазометану до ацетилену.
2. Взаємодія гідразину, алкіл- або арилгідразинів з 1,3-дикарбоиіль-ними сполуками. Цей спосіб частіше використовують для добування гомологів піразолу. Так, при взаємодії гідразину з ацетилацетоном утворюється 3,5-диметилпіразол.
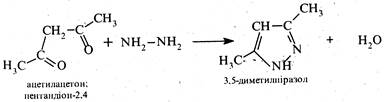
Б. Фізичні властивості
Піразол — безбарвна кристалічна речовина (т. пл. 70 °С, т. кип.187 °С) зі слабким запахом піридину; добре розчинна у воді, етанолі та ефірі.
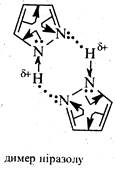
В неполярних розчинниках існує у формі димерів і тримерів через утворення міжмолекулярних водневих зв'язків.
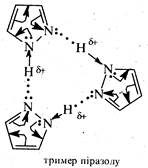
1. Кислотність і основність. Кислотно-основні властивості піразолу зумовлені наявністю в його структурі атомів азоту пірольного та піридинового типів (див. розд. 3.1).
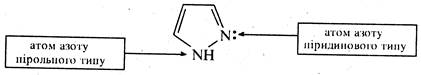
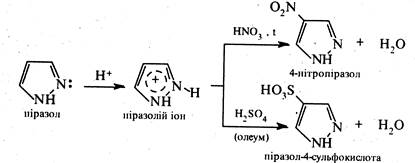
За рахунок атома азоту піридинового типу піразол виявляє основні властивості (pKВН+ 2,53), за рахунок атома азоту пірольного типу — слабкі кислотні властивості (рКα ~ 14). Отже, піразол є амфотерною сполукою та здатний вступати в реакції як з мінеральними кислотами, так і з лугами, утворюючи при цьому солі, наприклад:
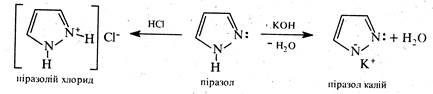
Солі піразолу вельми стійкі сполуки. їх стабільність зумовлена делокалізацією позитивного заряду між усіма атомами циклу в катіоні піразолію, або негативного заряду в піразолід-аніоні.
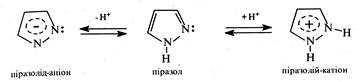
Наявність у молекулі піразолу рухомого атома водню NH-групи та оснбвного центру – атома азоту піридинового типу є причиною виникнення прототропної, або так званої азольної таутомерії. Прототропна таутомерія піразолу та його гомологів зумовлена переміщенням атома водню NH-групи до атома азоту піридинового типу.
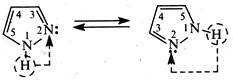
В результаті таутомерних перетворень положення 3 та 5 у молекулі піразолу рівноцінні. Так, 3-метилпіразол і 5-метилпіразол є таутомерними формами одної та тої самої сполуки.
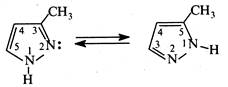
Причому, міграція атома водню відбувається настільки швидко, що виділити індивідуальні таутомери не виявляється можливим. Тому в назвах таких сполук поряд з цифрою, що вказує положення замісника, в дужках наводиться цифра, котра позначає можливість відліку від іншого, хімічно ідентичного азоту. Так, наведену вище сполуку називають 3(5)-метилпіразол.
2. Реакції з електрофільними реагентами. Через електроноакцепторний вплив атома азоту піридинового типу реакційна здатність піразолу з електрофільними реагентами зменшена. При цьому напрям реакцій залежить від природи атакуючого реагенту і умов їх проведення.
Алкілування і ацилювання піразолу проходить звичайно з Утворенням продуктів N-заміщення. Так, при взаємодії піразолу з йодметаном у нейтральному або лужному середовищі утворюється N-метилпіразол.
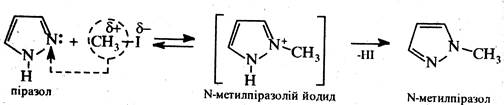
Спочатку електрофільний реагент СН3І атакує атом азоту піридинового типу молекули піразолу з утворенням солі— N-метилпіразоліййодиду, котра відщеплює НІ, перетворюючись на кінцевий продукт реакції. Ця реакція проходить з переносом реакційного центру.
Аналогічно відбувається ацилювання піразолу.
Реакції з сильними електрофільними реагентами (нітрування, сульфування, галогенування) відбуваються з утворенням продуктів заміщення по атому вуглецю в положенні 4 (найвіддаленіше від атомів азоту положення). Оскільки піразол не виявляє ацидофобних властивостей, нітрування та сульфування його проводять концентрованими азотною та сірчаною кислотами відповідно. Обидві реакції проходять через стадію утворення неактивного катіона піразолію.
Галогенування піразолу відбувається порівняно легко.
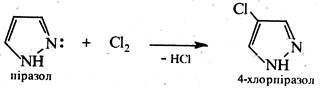
3. Реакції відновлення. При відновленні піразолу воднем у момент виділення (С2Н5ОН + Na) утворюється частково гідрований продукт— піразолін. Гідрування в присутності каталізатора приводить до утворення повністю гідрованого похідного — піразолідину.
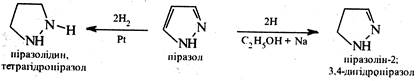
Піразолін і піразолідин є набагато сильнішими основами, ніж піразол. Вони виявляють властивості вторинних аліфатичних амінів.
Г. Найважливіші похідні піразолу
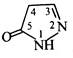 Піразолон-5 (2-піразолінон-5). Це безбарвна кристалічна речовина (т. пл. 165 °С), добре розчинна у воді та етиловому спирті, погано розчинна в ефірі та толуолі. Піразолон-5 є таутомерною сполукою та може існувати в СН2, ОН- і NH- формах.
Піразолон-5 (2-піразолінон-5). Це безбарвна кристалічна речовина (т. пл. 165 °С), добре розчинна у воді та етиловому спирті, погано розчинна в ефірі та толуолі. Піразолон-5 є таутомерною сполукою та може існувати в СН2, ОН- і NH- формах.
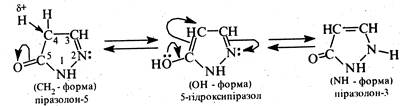
У зазначеній рівновазі істотно переважає СН2-форма, тому вважають за кращу назву сполуки — піразолон-5.
Ядро піразолону-5 входить у структуру низки лікарських препаратів, зокрема, антипірину, амідопірину і анальгіну. Як вихідну речовину для добування лікарських препаратів піразолонового ряду використовують 3-метил-1-фенілпіразолон-5. Цю сполуку було вперше синтезовано в 1883 р. німецьким хіміком-органіком Л.Кнорром з ацетооцтового ефіру та фенілгідразину.
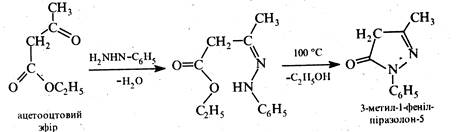
3-Метил-1-фенілпіразолон-5, подібно до незаміщеного піразолону-5, може існувати у трьох таутомерних формах:
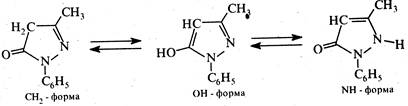
Установлено, що в неполярних розчинниках переважає СН2 -форма, а у водних розчинах NH- форма. При взаємодії 3-метил-1-фенілпіразолону-5 (у NH- формі) з йодистим метилом утворюється 2,3-диметил-1 -фенілпіразолон-5 (антипірин).
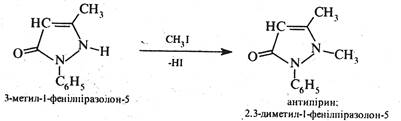
Антипірин — безбарвна кристалічна речовина (т. пл. 114 °С) з гіркуватим смаком, добре розчинна у воді. Застосовується у медицині як жарознижуючий та болезаспокійливий засіб.
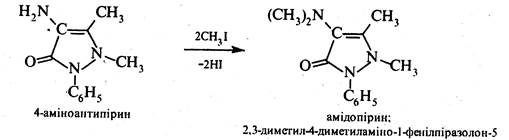
У молекулі антипірину атом водню при вуглецю в положенні 4 піразолінового циклу виявляє значну рухливість. При дії азотної кислоти він легко заміщується на нітрогрупу. Наступне відновлення 4-нітрозоантипірину, що утворився, дає 4-аміноантипірин вихідний продукт у синтезі амідопірину і анальгіну.
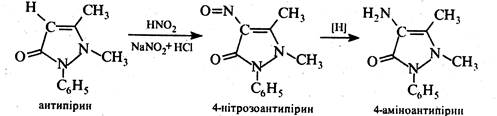
Амідопірин добувають метилуванням 4-аміноантипірину:
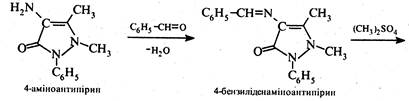
Анальгін синтезують за схемою:
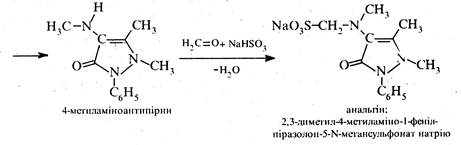
Амідопірин анальгін застосовують у медицині як жарознижуючі та болезаспокійливі засоби, причому амідопірин сильніше виявляє жарознижуючу дію, анальгін - болезаспокійливу.
 2015-07-14
2015-07-14 6933
6933








