1. Пиррол, фуран и тиофен относятся к гетероциклическим соединениям. Какие признаки используются для классификации этих соединений? Структурным фрагментом каких биологически важных соединений является пиррол?
2. Объясните, почему пиррол является амфотерным соединением. Напишите уравнения реакций, доказывающие амфотерность пиррола? Приведите схему реакции гидрирования пиррола водородом. Какими свойствами обладает продукт реакции?
3. Напишите схемы реакций нитрования и сульфирования пиррола и фурана. Почему эти реакции нельзя проводить в сильнокислой среде? Объясните с учетом мезомерии, почему в смеси продуктов преобладают α-изомеры.
4. Индол, как и пиррол, является слабым основанием и тоже ацидофобен. В чем заключается различие в реакциях электрофильного замещения между индолом и пирролом? Структурным фрагментом каких биологически важных соединений является индольная система? Какие свойства проявляет атом азота в индоле?
5. Наиболее типичным представителем ароматических гетероциклов является пиридин. Его производные имеют важное биологическое значение. Объясните, в чём заключается основное отличие пиридина от бензола. Какими критериями ароматичности обладает молекула пиридина?
6. Приведите схему реакции пиридина с водой. Почему водный раствор изменяет окраску лакмуса? Какой структурный фрагмент обуславливает основные свойства пиридина?
7. Кордиамин (N,N-диэтиламид никотиновой кислоты) применяют в медицине как стимулятор центральной нервной системы. Напишите схему синтеза его исходя из β-пиколина (3-метилпиридина). Назовите продукт по международной номенклатуре.
8. Пиразол и имидазол относятся к 1,2- и 1,3-азолам. Объясните, почему по кислотности эти гетероциклы превышают пиррол? Могут ли молекулы этих соединений образовывать межмолекулярные ассоциаты, и в каких условиях? Преимущественно какие атомы углерода в пиразоле и имидазоле подвергаются электрофильной атаке?
9. Реакции имидазола с электрофильными реагентами могут протекать как по атому азота, так и по атомам углерода. Приведите схемы реакций алкилирования, нитрования и сульфирования имидазола и назовите продукты реакции по международной номенклатуре.
10. Напишите схему реакции имидазола с калием в жидком аммиаке. Какое строение имеет образующаяся соль? Опишите строение аниона с учетом мезомерии.
11. В результате реакции декарбоксилирования α-аминокислоты, содержащей фрагмент имидазола, образуется биогенный амин, который можно получить по следующей схеме:
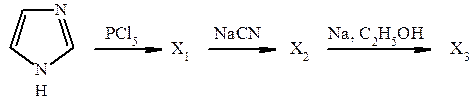
Приведите строение промежуточных и конечных продуктов. В результате декарбоксилирования какой α-аминокислоты получается этот амин в организме?
12. Гидрокси- и аминопроизводные пиримидина – урацил, тимин и цитозин являются компонентами нуклеиновых кислот. Приведите структурные формулы этих соединений и назовите их по международной номенклатуре. Какие таутомерные формы характерны для этих соединений? Какой продукт образуется при действии азотистой кислоты на цитозин?
13. Барбитуровая кислота – одно из первых синтетических производных пиримидина. Назовите это соединение по международной номенклатуре. Напишите схему синтеза барбитуровой кислоты из мочевины и малонового эфира. Какое применение находят в медицине её производные? В каких таутомерных формах может существовать эта кислота?
14. Пурин представляет собой конденсированную систему пиримидина и имидазола и по всем критериям относится к ароматическим соединениям. Объясните, почему атомы углерода в пурине невосприимчивы к элекрофильной атаке? В каких таутомерных формах он существует в кристаллическом состоянии и в растворе?
15. Важнейшими гидроксипроизводными пурина, образующимися в результате метаболизма нуклеиновых кислот в организме, являются мочевая кислота, ксантин и гипоксантин. В какой таутомерной форме преимущественно существуют эти соединения? Напишите схему реакции, которая используется для качественного определения мочевой кислоты и ксантина.
Литература
1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М.; Медицина, 1991.
2. «Руководство к лабораторным занятиям по органической химии» под редакцией Тюкавкиной Н.А. Дрофа. М. 2003.
3. «Органическая химия» под редакцией Тюкавкиной Н.А. Дрофа. М. 2003.
4. Слесарев В.Н. Основы химии живого. ХИМИЗДАТ. Санкт-Петербург. 2000.
5. Грандберг И.И. Органическая химия. Академкнига. М. 2008.
6. Травень В.Ф. Органическая химия. Академкнига. М. 2008.
7. Джилкрист Т., Химия гетероциклических соединений. Мир. М. 1966.
 2015-07-14
2015-07-14 800
800








