а) Формула хлорангидрида угольной кислоты получается подстановкой атомов хлора вместо ОН-групп кислоты:

б) Формула бромангидрида фосфористой кислоты выводится аналогичным образом:
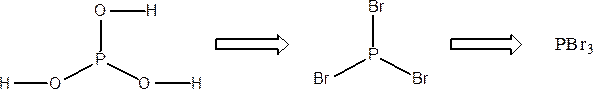
Принципиально возможны неполные галогенангидриды, т.е. продукты частичного замещения гидроксильных групп на атомы галогена, а также смешанные галогенангидриды, содержащие атомы различных галогенов, например:
SO2(OH)Cl или HSO3Cl, PBrClF, SOClF
Галогенангидриды можно называть по-русски, как это делается в случае оксокислот, при этом название соединения определяется названием галогенов и кислот, производными которых являются рассматриваемые галогенангидриды, например:
COCl2 – хлорангидрид угольной кислоты;
POBr3 – бромангидрид ортофосфорной кислоты;
SiF4 – фторангидрид ортокремневой кислоты;
SOClF –фтор-хлорангидрид сернистой кислоты:
HSO3Cl – монохлорангидрид серной кислоты или хлоросерная кислота.
Систематические названия галогенангидридов более точно отражают состав каждого из них, например:
COCl2 – дихлорид оксоуглерода;
POBr3 – трибромид оксофосфора;
PBr5 – пентабромид фосфора;
SOClF – фторид-хлорид оксосеры;
CrO2Cl2 – дихлорид диоксохрома.
Электроположителиные части некоторых кислородсодержащих галогенангидридов и основных солей имеют традиционные названия, например:
CrO22+ – хромил, UO22+ – уранил, TiO2+ – титанил,
NO+ – нитрозил, NO2+ – нитроил (нитроний), SbO+ – стибил,
BiO+ – висмутил, SO2+ – тионил, SO22+ – сульфонил.
Поэтому ряд галогенангидридов можно называть по типу солей:
CrO2Cl2 – хлорид хромила;
SOF2 – фторид тионила.
Как известно, нет резкой грани между свойствами металлических и неметаллических элементов. Некоторые элементы (Ge, Sn, As, Sb, Te) занимают как бы промежуточное положение, а их свойства и свойства соединений являются «переходными», проявляют некоторую двойственность.
Одним из примеров проявления таких переходных свойств является характер соединений элемента с галогеном. Так, если сравнивать физические и химические свойства галогенидов элементов главной подгруппы V группы Периодической системы (см. таблицу 3), то нетрудно сделать вывод, что два левых представителя являются типичными галогенангидридами и необратимо разлагаются водой:
NCl3 + 2H2O Þ 3HCl + HNO2 (2HNO2 Þ NO + HNO3);
PCl3 + 3H2O Þ 3HCl + H3PO3.
Таблица 3 Свойства галогенидов элементов V-группы
NCl3 PCl3 AsCl3 SbCl3 BiCl3
| Физическое состояние | жидкость | жидкость | жидкость | твёрдое кристаллич. | Твёрдое кристаллич. |
| Tплавления, оС | <–40 | –91 | –16 | 73,4 | |
| Ткипения, оС | 131,3 | 218,6 |
Два правых представителя ряда – типичные соли, и обратимо гидролизуются с образованием основных солей:
SbCl3 + H2O  SbOCl¯ + 2HCl;
SbOCl¯ + 2HCl;
BiCl3 + H2O  BiOCl¯ + 2HCl.
BiOCl¯ + 2HCl.
AsCl3 характеризуется свойствами промежуточными между свойствами галогенангидрида и соли, так его гидролиз протекает как галогенангидрида, но реакция обратима:
AsCl3 + 3H2O  3HCl + H3AsO3.
3HCl + H3AsO3.
Таким образом, нельзя провести резкой границы, как между металлами и неметаллами, основными оксидами и кислотными оксидами, так и между солями и галогенангидридами.
 2015-07-14
2015-07-14 2869
2869








