| ПЕРВИЧНЫЕ | ВТОРИЧНЫЕ | ТРЕТИЧНЫЕ |
| R – CH2 – OH | R – CH – OH │ R | R │ R – C – OH │ R |
| CH3 – OH МЕТАНОЛ CH3 – CH2 – OH ЭТАНОЛ | CH3 – CH – OH │ CH3 ПРОПАНОЛ - 2 | CH3 │ CH3 – C – OH │ C2H5 2- МЕТИЛБУТАНОЛ – 2 |
6. Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за счёт функциональной группы (-ОН)
А) Водородная связь между молекулами спиртов
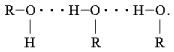
|
Б) Водородная связь между молекулами спирта и воды
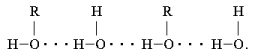
|
Вывод:
1) В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С,
а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
2) Способность спиртов образовывать межмолекулярные водородные связи не только влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый, этиловый, н -пропиловый и изопропиловый) растворяются в воде неограниченно.
3) Отсутствие газов в гомологическом ряду предельных одноатомных спиртов.
|
|
|
7. ПОЛУЧЕНИЕ ПРЕДЕЛЬНЫХ ОДНОАТОМНЫХСПИРТОВ
| Промышленность |
|
| Лаборатория |
| Взаимодействие галогеналканов R-Г с водными растворами щелочей t, водн.р-р. CH3Cl+ NaOH → CH3OH + NaCl (р. обмен) |
 2015-07-14
2015-07-14 542
542








