Классификация, методы синтеза, свойства
Гетероциклическими называются соединения, циклы которых включают кроме атомов углерода один, или несколько атомов других элементов, чаще всего азота, серы, кислорода, которые называются гетероатомами.
Эти соединения очень широко распространены в природе и многие являются лекарственными препаратами или в качестве исходных продуктов для синтеза лекарственных препаратов.
Классификация
По числу атомов в цикле: 3х, 4х, 5ти, 6ти и 7ми – членные гетероциклы.
Наиболее часто встречающиеся и наиболее интересующие нас 5ти и 6ти – членные гетероциклические соединения и этиленимин - 3х – членный.
Пятичленные, шестичленные классифицируются по числу и характеру гетеро-атома.
Трехчленные - этиленимин (азиридин):
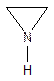
5ти – членные с одним гетероатомом:
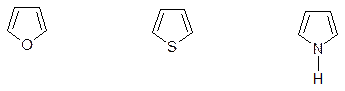
фуран тиофен пиррол
Родоначальниками ряда являются ароматические соединения. Гидрированные соединения либо имеют собственные названия, либо обозначаются как дигидро- или тетрагидро- с указанием номера гидрированных атомов: дигидрофуран, тетрагидропиррол или пирромидин.
5ти – членные с несколькими гетероатомами:
Обычно имеют собственные названия, либо добавляя приставку (окса-, аза-, тиа-) к более простому гетероциклу. Наиболее интересны для нас:
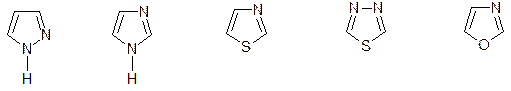
пиразол имидазол 1,3-тиазол 1,3,4-тиадиазол 1,3-оксазол
(или 3-азатиофен)
Если имеются заместители, то за основу берется название гетероцикла, например, 2-метил-1,3-тиазол.
Гетероциклы могут образовывать конденсированные системы. Из пятичленных конденсированных гетероциклов для нас интересен индол (2,3-бензпиррол):
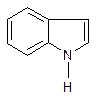
6ти – членные гетероциклы с одним или несколькими гетероатомами:
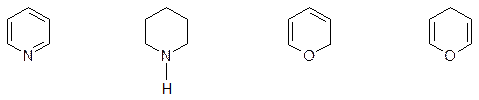
пиридин пиперидин б – пиран г – пиран
Из конденсированных, содержащих 1 гетероатом:

хинолин изохинолин
(можно называть как производные бензола: пирозин - 1,4-диазабензол).
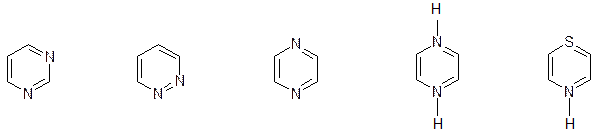
пиримидин пиридазин пиразин пиперазин тиазин
(оксазин)
7ми – членные:

азепин 1,4-диазепин
Ароматические гетероциклы.Особенности ароматичности
Ароматическая структура должна содержать 4n +2 обобщенных электронов, которые не участвуют в образовании у – связей.
Пример – бензол: 6 углеродных атомов, находящихся в состоянии SP2 гибридизации (их валентные электроны находятся в состоянии SP2). Остаются 6 неспаренных электронов, облака которых располагаются перпендикулярно плоскости кольца и образуют не отдельные двойные связи, а единую сопряженную систему. Ароматическая система очень устойчива к действию окислителей (бензол не окисляется KMnO4, K2Cr2O7 и др.). Практически невозможны реакции присоединения по насыщенным связям (за исключением радикального присоединения).
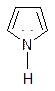 Ароматичность пятичленных гетероциклов с двумя р – связями объясняется тем, что одна свободная пара электронов O, S или N участвует в ароматической делокализации электронов и образовании ароматического скелета, т. е. 4 Р электрона углеродных атомов и 2 электрона гетероатома.
Ароматичность пятичленных гетероциклов с двумя р – связями объясняется тем, что одна свободная пара электронов O, S или N участвует в ароматической делокализации электронов и образовании ароматического скелета, т. е. 4 Р электрона углеродных атомов и 2 электрона гетероатома.
Для шестичленных гетероциклов 1 или несколько гетероатомов отдают по 1 Р – электрону в ароматический скелет, как, например, в пиридине. Понятно, почему пиридин является основанием (или имидазол), а пиррол не является (сравнение гетероциклов).
При этом, гетероциклы оттягивают на себя электронную плотность.
В пятичленных гетероциклах: повышенная активность к электрофильному замещению (повышенная нуклеофильность углеродных атомов); пониженная нуклеофильность гетероатомов. Особая подвижность протона при атоме N (кислотные свойства протона).
Возросшая способность к нуклеофильному замещению в молекуле пиридина:

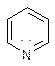
группа = N - заместитель второго рода, и как - NO2 в бензоле ориентирует электрофильное замещение в м-положение, но очень сильно ориентируют нуклеофильное замещение в о- и п- положение (т. е. в б- и г- положение), т. е. по сравнению с бензолом возрастают возможности как электрофильного, так и нуклеофильного замещения.
Сумма:
Образование ароматического скелета, вовлекающего неподеленную пару электронов гетероатома, имеет следствием
1) сумма ароматических свойств гетероцикла;
2) потеря нуклеофильных свойств гетероатомом. Так, N, S, O в пятичленных гетероатомах (тиофен, фуран, пиррол) не способны к комплексообразованию).
Но: так обезличиваются только те гетероатомы, электронные пары которых входят в ароматический секстет; и это не относится ко второму гетероатому пятичленных гетероциклов (напр., имидазол), ни даже к первому гетероатому у шестичленных гетероциклов (пиридин).
Частично или полностью гидрированные гетероциклы – дитетрагидропиридин, дигидрофуран и т. д. по своим функциональным проявлениям похожи на соответствующие алифатические соединения. Оставшиеся двойные связи имеют обычную активность (легко окисляются KMnO4, реакции присоединения), гетероатом проявляет наличие свободной пары электронов и нуклеофилен.
Наличие гетероатомов, особенно нескольких, в гетероцикле обуславливают большую способность к раскрытию цикла, рециклизации, и особенно к различного рода таутомерным превращениям. Кроме того, некоторые гетероциклы характеризуются наличием одновременно двух типов таутомерии – кето-енольной и имино-имидольной.
Общие методы синтеза и химические свойства гетероциклов
Пятичленные гетероциклы
Фуран, тиофен, пиррол, пиразол, имидазол.
Общий метод
1) Исходные – дегидратация 1,4-дикарбонильных соединений соответственно в присутствии водоотнимающих средств: P2O5, P2S5, NH3.
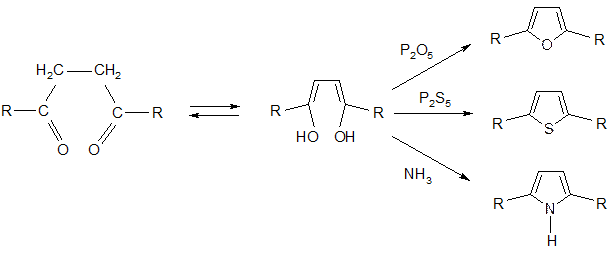
2) Взаимопревращения:
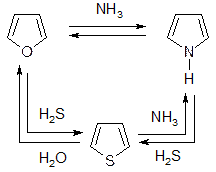
При t = 400оС в токе  газов. соотв.: H2S, NH3, H2O.
газов. соотв.: H2S, NH3, H2O.
3) синтез фурана – дегидратация пентоз (природных):
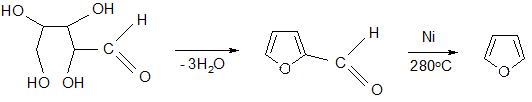
фурфурол
4) Из слизевой кислоты – продуктов окисления сахаров:
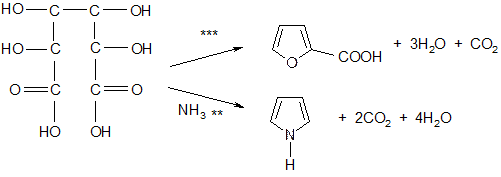
** пиролиз аммониевой соли
*** сухая перегонка
Тиофен так нельзя получить.
 2015-07-14
2015-07-14 4883
4883
