 п-ацетаминофенол (Paracetamolum)
п-ацетаминофенол (Paracetamolum)
Белые или бледнокремовые кристаллы, tпл = 168-172оС. Благодаря – ОН группе хорошо растворим в щелочах, также в спирте, плохо в воде.
Синтез из п-аминофенола: паранитрофенол восстанавливают сероводородом
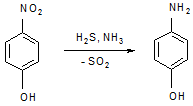
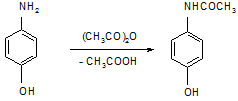
Наличие фенольного гидроксила дает реакцию с FeCl3 с образованием сине-фиолетового окрашивания.
В кислой среде с К2С22О7 – образование индофенольного красителя фиолетового цвета.
Сульфаниламидные препараты
(производные амидов сульфаниловой кислоты)
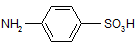
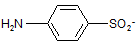
Сульфаниловая кислота не является лекарственным препаратом, но ее амид – эффективный фармацевтический препарат и служит источником для большого числа лекарственных препаратов, сходных по строению и характеру лечебного действия.
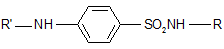
Общая формула:
Сульфаниловая кислота:
Амид:
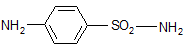
Еще в 1908г. был синтезирован п-аминобензолсульфамид – другими словами, сульфаниламид, который впоследствии стал белым стрептоцидом, как произв. для синтеза азокрасителей.
В 1934г. впервые был получен противомикробный эффект у азокрасителя – производного сульфаниламида – пронтозила.
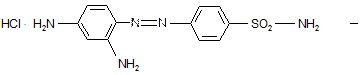
пронтозил
Это солянокислая соль, была названа красным стрептоцидом. Это – убийца стрептококков – новая эра в развитии химиотерапии.
Химиотерапевтическими средствами называют такие вещества, которые избирательно действуют на патогенные микроорганизмы, вирусы или новообразования, не влияя на макроорганизм.
Одновременно с синтезом сульфаниламидных препаратов начались глубокие биохимические работы по изучению действия этих препаратов на микробные клетки. А они оказались очень эффективными против стрептококков, стафилококков, пневмококков и др.
Уже в 1935г. было установлено, что красный стрептоцид в организме расщепляется с образованием двух продуктов:
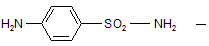
высокоактивный сульфаниламид и
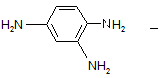
совершенно неактивный против микробов, высокотоксичный 1,2,4-триаминобензол
Т. о. оказалось, что давно известный сульфаниламид – высокоэффективное химиотерапевтическое вещество. А активностью обладают те соединения, которые содержат в качестве основы остаток сульфаниламида. Сульфаниламид – белый стрептоцид.
В зависимости от положения заместителей все сульфаниламидные препараты можно разделить на 3 группы:
1. Препараты, у которых замещение одного атома водорода произошло в сульфаниламидной группе (R) - наиболее распространенный тип.
2. Препараты, у которых замещение водорода произошло в ароматической аминогруппе (R’).
3. Препараты, у которых замещены одновременно 2 атома водорода – в сульфаниламидной группе и в аминогруппе (немногочисленная группа).
Представитель первой группы:
Этазол
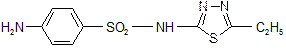
2-(п-аминобензолсульфамидо)-5-этил-1,3,4-тиадиазол
Представители второй группы встречаются редко:
Стрептоцид растворимый
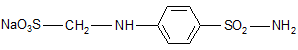
п-сульфамидобензоламинометансульфат натрия
Представитель третьей группы:
Фталазол
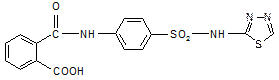
2-(п-(о-карбоксибензамидо)-бензолсульфамидо)-тиазол
Одновременно с синтезом сульфамидов шла работа по изучению связи между строением и физиологической активностью. В результате сделаны следующие выводы:
1. Для того, чтобы соединение обладало активностью, необходимо наличие сульфанильного радикала в молекуле препарата
2. Если аминогруппу в положении 4 или ее водородные атомы заменить такими радикалами, при которых в организме не может образоваться свободная ароматическая аминогруппа, активность полностью исчезает.
Если заместить на - OH, - COOH, - Cl – активность исчезает;
- CONH -, R - N = N - – легко гидрализуются, активность сохраняется.
3. Перемещение аминогруппы из положения 4 в 2 или 3 бензольного ядра приводит к полной потере активности.
4. Введение в бензольное ядро дополнительных радикалов значительно снижает либо полностью уничтожает противомикробную активность.
5. `При замещении водорода сульфамидной группы можно получить соединения с различной степенью токсичности с сохранением противомикробного действия (которое может быть увеличено или уменьшено по сравнению со стрептоцидом – сульфаниламидом).
Механизм физиологической активности
Сульфаниламиды обладают бактериостатическим действием, т. е. они не убивают микробные клетки за счет денатурации их белков, как, напр., бензойная кислота, а препятствуют размножению бактерий за счет нарушения процесса получения микроорганизмами “ростовых факторов”.
Установлено, что для нормальной жизнедеятельности микробной клетки необходимо дигидрофолиевая кислота, которая синтезируется в микробной клетке из дигидропрерина (основание), глутаминовой кислоты и ПАБК.
Схематично синтез дигидрофолиевой кислоты может быть представлен
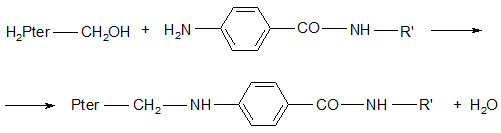
R’ – остаток глутаминовой кислоты.
В присутствии сульфаниламидного препарата на активном центре фермента происходит конкурентная реакция
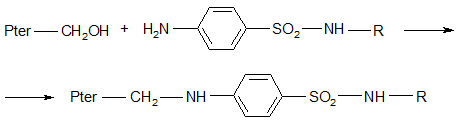
Т.о. введение сульфаниламида препятствует синтезу дигидрофолиевой кислоты. Продукт, полученный при этом взаимодействии, не может быть использован бактериальной клеткой в качестве ростового фактора и рост, а, следовательно, и размножение бактерий останавливается вследствие различия в химическом строении и из-за иного размещения плотности электронов на аминогруппах. ПАБК и сульфаниламид конкурируют за дигидроPter. Действие – конкурентное ингибирование.
В то же время, скорость протекания реакции синтеза дигидрофолиевой кислоты из ПАБ кислоты во много раз быстрее, чем скорость конкурентной реакции. Поэтому для получения терапевтического эффекта сульфаниламиды назначаются в больших (“ударных”) дозах для создания высокой концентрации в крови, которые могли бы предупредить возможность использования микробами ПАБ, содержащейся в тканях организма.
Кроме того, при лечении сульфаниламидными препаратами противопоказания одновременны с принятием лекарств, в молекулу которых входит ПАБК – новокаин, дикоин, прокаин и др.
Синтез
Рассмотрим общие методы синтеза.
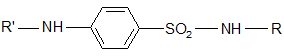
Синтез препаратов состоит из трех стадий:
2. Получение хлорангидрида сульфаниловой кислоты;
3. Получение соответствующего аминопроизводного R – NH2;
4. Конденсация хлорангидрида сульфаниловой кислоты с аминопроизводным.
1. Исходные продукты должны содержать ацилорованную аминогруппу, что позволяет предохранить ее от дальнейших превращений в ходе синтеза. На последнем этапе ацилорованный амин гидролизуют.
Хлорангидрид сульфаниловой кислоты можно получить двумя способами:
а) из сульфаниловой кислоты, которую предварительно ацетилируют – защита аминогруппы:
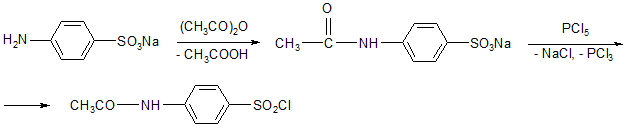 хлорангидрид N-ацетилсульфаниловой кислоты
хлорангидрид N-ацетилсульфаниловой кислоты
б) из ацетанилида в присутствии хлорсульфоновой кислоты

ацетанилид
1. Амины синтезируются индивидуально для каждого препарата.
2. Полученный хлорангидрид N-ацетилсульфаниловой кислоты конденсируют с соответствующим амином:
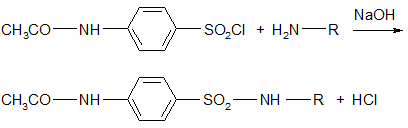
Реакцию следует проводить в слабощелочной среде, чтобы предотвратить взаимодействие выделяющейся HCl с амином: R – NH2. HCl, иначе реакция конденсации не пойдет.
4. После этого ацильную группу омыляют, т. к. ацильные производные не обладают терапевтическим эффектом:
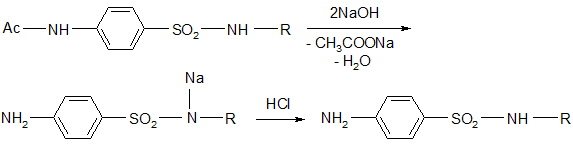
- вначале получают натриевую соль, которую обрабатывают кислотой. После этого в некоторых случаях (фталазол, фтазин) полученное соединение ацилируют по аминогруппе.
Физические и химические свойства.
Реакции на подлинность.
Сульфаниламиды – белые с желтоватым кристаллические вещества, плохо растворимы в воде, спирте, растворимы в ацетоне, щелочах и кислотах.
Для повышения растворимости в воде иногда применяют натриевые соли препаратов.
Общие химические свойства и реакции на подлинность (качественные реакции):
1. Большинство сульфаниламидных препаратов являются амфотерными соединениями – проявляют основные и кислотные свойства.
Основные свойства (слабые) обусловлены наличием аминогруппы в ароматическом ядре. Основания растворяются в кислотах с образованием солей:
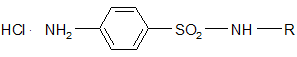
2. Кислые свойства проявляются сильнее и обусловлены наличием подвижного протона у амидной группы, который способен замещаться на металл с образованием соли. Поэтому они хорошо растворяются в щелочах и карбонатах, причем это истинная соль, атом азота заряжен отрицательно – SO2 – N- – R.
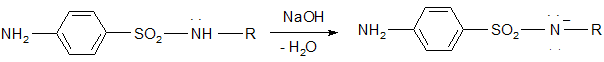
3. Наличие аминогруппы в ароматическом ядре придает способность атомам водорода в орто-положении легко замещаться. Поэтому, имея ароматическое ядро, сульфаниламиды могут легко галоидироваться, нитроваться, сульфироваться (из-за наличия первичной аминогруппы)
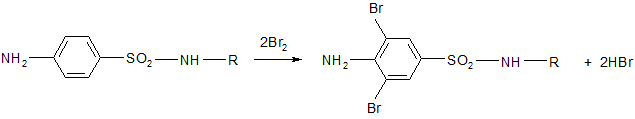
дибромсульфаниламид
4. Имея в молекуле свободную аминогруппу, сульфаниламиды могут диазотироваться и при сочетании с фенолами давать азокрасители (реакции азосочетания).
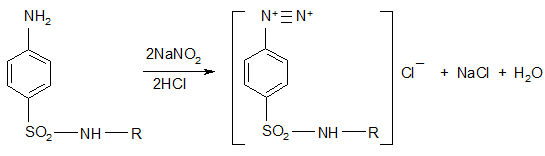

азокраситель вишнево-красного цвета, либо в некоторых случаях оранжево-красный осадок.
** в-нафтол
5. Водород амидной группы обуславливает возможность взаимодействия с солями тяжелых металлов CuSO4, CoSO4, FeSO4 и т. д. с образованием окрашенных внутрикомплексных соединений:
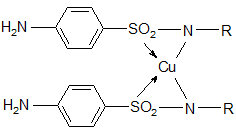
При этом окраска возникает различная для различных соединений – качественная реакция. Сульфанил натрия с Сu2+ дает осадок голубовато-зеленого цвета; этазол – травянисто-зеленый; сульфадиметоксин – желтый с зеленым оттенком, амфорный и т. д.
6. Все сульфаниламидные препараты содержат серу, которую можно определить, окислив препарат конц. HNO3, при этом образуется H2SO4.
Препарат + конц. HNO3  H2SO4 + CO2
H2SO4 + CO2 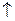 + NO
+ NO 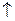 + NO2
+ NO2 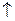 + H2O + NH4NO3
+ H2O + NH4NO3
H2SO4 определяют с BaCl2: H2SO4 + BaCl2 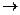 BaSO4
BaSO4 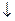 + 2HCl
+ 2HCl
1. Нитритометрия (индикатор – нейтральный красный).
2. Метод нейтрализации
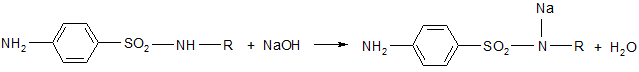
Т. к. возможен гидролиз образующейся соли, то титрование необходимо проводить в неводных растворителях – обычно ацетон - спиртовая смесь. Для очень слабых кислот – в диметилформамиде. Точка эквивалентности определяется либо потенциометрически, либо по индикатору тимол-фталеину. Натриевые соли препаратов титруют кислотой в спиртовоацетоновой среде с индикатором метиловым оранжевым.
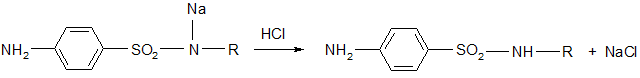
Применение:
Применяют для лечения инфекционных заболеваний, вызываемых стрептококками, гопококками, пневмококками, стафилококками, менингококками, кишечной палочкой и др.
По характеру терапевтического действия их можно разделить на 3 группы:
3. Препараты, создающие высокие концентрации в крови (стрептоцид, этазол, сульфадиметоксин, сульфален и др.).
4. Препараты, создающие высокие концентрации в кишечнике из-за плохого всасывания в кровь (фталазол, фтазин).
5. Препараты, создающие высокие концентрации в почках и мочевых путях (уросульфан, сульфадимезин).
Классификация по продолжительности действия
1. Короткодействующие препараты – быстро всасываются, но и быстро выделяются, поэтому каждые 4 часа - новая доза (сопротивление в течение 6 часов).
2. Препараты пролонгированного действия (сульфапиридозин, сульфадиметок-син).
3. Препараты сверхдлительного действия.
Короткодействующие препараты:
1. Стрептоцид Streptocidum
2. Сульфацил-Na Sulfacylum-natrium
3. Уросульфан Urosulfanum
п-аминобензолсульфонилмочевина
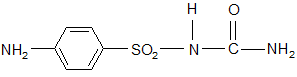
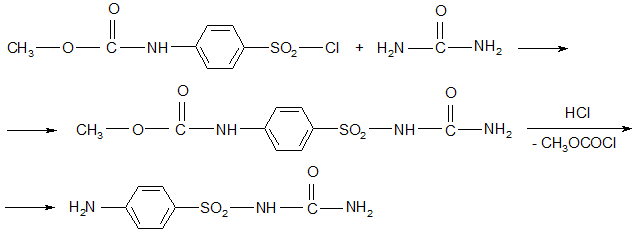
Синтез:
Из хлорангидрида N-ацетильного производного сульфаниловой кислоты и мочевины (на самом деле из карбометоксисульфаниловой кислоты):
Химиотерапевтическое действие наиболее выражено к стафилококкам и E.coli.
Быстро всасывается в кровь, выделяется почками в неизменном виде (не метаболизируется печенью) – выделяется быстро, поэтому в моче создается высокая концентрация препарата. Не наблюдается отложения препарата в мочевыводящих путях.
Лечение циститов, ниелитов, ниелонефритов.
4. Этазол Aethazolum
Самый распространенный препарат, но не самый лучший. Название начинается от гетероцикла (так почти всегда называют):
2-(п-аминобензолсульфамидо)-5-этил-1,3,4-тиадиазол.
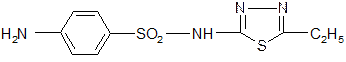
Синтез:
1-ая стадия – общая для всех.
2-ая стадия – синтез 2-аминотиадиазола:
2. Конденсация хлорангидрида пропионовой кислоты с тиосемикарбозидом:
3CH3CH2COOH + PCl3 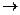 3CH3CH2COCl + H3PO3
3CH3CH2COCl + H3PO3
пропионовая кислота
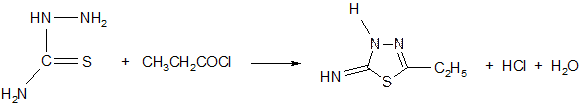
тиосемикарбозид
Полученный имин дает таутомерную форму – амин (в присутствии пиридина).
Аминоформу конденсируют с п-ацетиламинобензолсульфохлоридом Ac – NH – Ph – SO2Cl - и дальнейший гидролиз в HCl (разб.).
Реакция с CuSO4 – травянисто-зеленый цвет (осадок).
Применять – каждые 4 – 6 часов высокую дозу.
Мало ацетилируется, быстро всасывается, почти не откладывается в почках. Активен против стрептококков, менингококков, гоппококков, дезинтирийных палочек и др.
Отрицательное качество – быстро выводится – надо часто применять в высоких дозах. Ударная доза – 2г. – 4-8 табл, и далее по 0,5г. каждые 4 часа.
5. Фталазол Phthalazolum
2-[п-(о-карбоксибензамидо)-бензолсульфамидо]-тиазол.
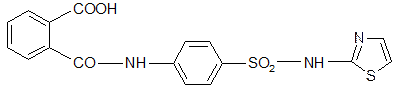
Синтез: Спекание фталиевого ангидрида и норсульфазола.
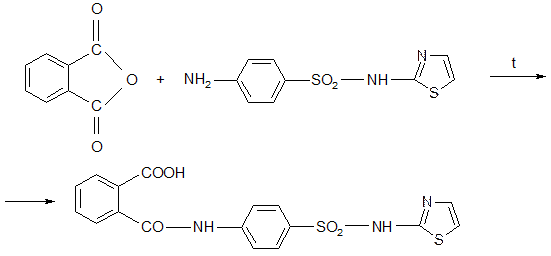
Фталазол не вступает в реакции диазотирования и азосочетания, поскольку не имеет свободной аминогруппы (не образует азокрасителей).
Подлинность препарата определяется по продуктам омыления разбавленной HCl – омыляет до норсульфазола – определяется по образованию азокрасителя. Реакция с хлорангидридом фталиевой кислоты при нагревании с конц. H2SO4 дает ярко-зеленое люминисцентное окрашивание.
Гидролиз – при нагревании. Без нагревания – очень слабый гидролиз (в HCl).
В желудке почти не гидролизуется. Очень плохо всасывается из желудка в кровь и в основном задерживается в кишечнике (накапливается). Постепенно происходит отщепление активной сульфамидной части молекулы, которая и оказывает антибактериальное действие непосредственно в кишечнике (выделяется активный норсульфазол).
Применяется при дизентириях, энтероколитах, гастроэнтеритах и т. д.
Для того, чтобы лекарственный препарат накапливался в кишечнике (слабое всасывание в желудке), надо обязательно блокировать (ацилировать) бензольную аминогруппу. Например, другой представитель
6. Фтазин Phthazinum
6-[п-(о-карбоксибензамидо)-бензолсульфамидо]-3-метоксипиридазин.
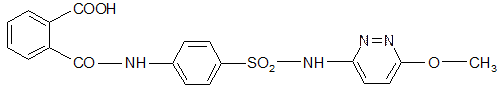
Сульфаниламидные препараты пролонгированного действия:
Эти препараты очень медленно выводятся почками из организма и не метаболизируются – надолго задерживаются в организме, что дает возможность значительно снизить дозы приема – значительно снижает побочные действия веществ.
Представители:
1. Сульфапиридазин Sulfapyridazinum
6-(п-аминобензолсульфамидо)-3-метоксипиридазин

Сульфадиметоксин, cульфален - обязательно наличие в качестве R – радикала 6-тичленного азо-гетероцикла, в котором 1 или 2 атома водорода замещены на метокси – OCH3 группы.
2.Сульфадиметоксин Sulfadimethoxinum
6-(п-аминобензолсульфамидо)-2,4-диметоксипиримидин.
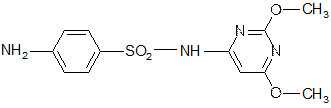
С Cu2+ дает реакцию грязно-желтого цвета с зеленоватым оттенком.
Растворим в разбавленных щелочах и кислотах (за счет свободной аминогруппы и амидогруппы) – реакции азосочетания, комплексообразования с CuSO4 и т. д.
Синтез: Конденсация ациламинобензолсульфохлорида
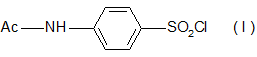
с 6-амино-2,4-диметоксипиримидином
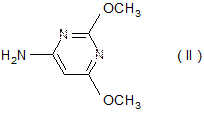
Соединение II получают следующим образом:
1) Конденсация циануксусной кислоты с мочевиной – образуется цианацетилмочевина,
где ** - последующая нейтрализация для образования – ОН из – ОNa; циклизация.
*** - метанол + NaOH, - 2NaCl:
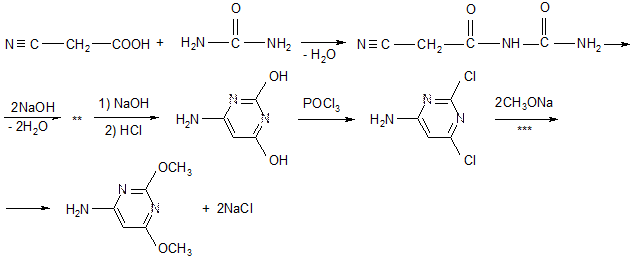
3) Конденсация и гидролиз ацетильной группы.
Применение:
Быстро всасывается из пищевого канала. После однократного приема принимают 2г., бактериостатическая концентрация создается через 2 часа и сохраняется в течение суток.
Схема: 1день – 2г, в последующие дни по 0,5 – 1г. в сутки (если 1г., то можно как и по 0,5 – 1 раз в сутки).
Угнетает рост стрептококков, стафилококков, пневмококков, дезинтирийных палочек и др.
Препараты сверхдлительного действия
Сульфален Sulfalenum
2-(п-аминобензолсульфамидо)-3-метоксипиразин.
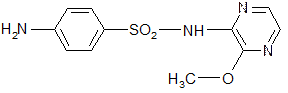
С Cu2+ дает осадок грязно-зеленого цвета, переходящий в зеленовато-голубой.
Применение:
После приема внутрь максимальная концентрация создается через 4 – 6 часов, бактериостатическая концентрация в крови сохраняется в течение 7 суток.
Схема приема: по 2г. 1 раз в неделю; или первый день 0,8-1г., последующие дни по 0,2-0,25г. ежедневно – для поддержания бактериостатической концентрации.
Назначают при: пневмониях, бронхопневмониях, бронхитах, фарингитах, уретритах, абсцессах, маститах, менингитах, отите и т. д.
 2015-07-14
2015-07-14 9985
9985








