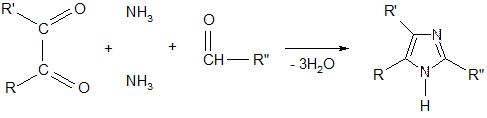
Из 1,2-дикарбонильных соединений, аммиака и альдегидов.
Фуран –
Промежуточные свойства между ароматическими соединениями и обычным диолом – за счет очень сильного оттягивания на себя р – электронов.
Очень легко окисляется (даже без KMnO4) на воздухе до малеинового ангидрида:
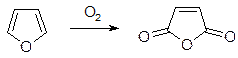
Довольно легко вступает в реакции присоединения по двойным связям. Несмотря на это, способен к реакции электрофильного замещения: сульфирование, нитрование, ацилирование по Фриделю – Крафтсу (с ангидридами или хлорангидридами):
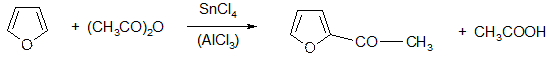
Тиофен
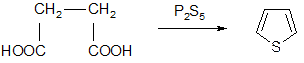
янтарная кислота
- другой крайний случай.
Чистый ароматик, как бензол. р – электроны не способны к реакциям присоединения. Не окисляется ни по атомам углерода, ни по сере в сульфониевые соединения (ни KMnO4, ни Н2О2) – может быть за счет свободных d – орбиталей серы. Тиофен вступает в реакции электрофильного замещения легче, чем бензол, например, сульфируется H2SO4 – на холоду (преимущественно в б – положении).
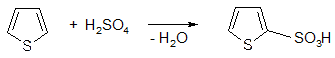
Пиррол
Можно восстановить водородом в момент выделения (рН 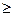 7), т. е. ведет себя как диен. Но это, пожалуй, и все реакции, где он ведет себя как диен.
7), т. е. ведет себя как диен. Но это, пожалуй, и все реакции, где он ведет себя как диен.
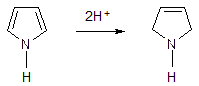
Атом N пиррола полностью лишен основных свойств и его иминогруппа обладает очень слабыми кислотными свойствами (как фенол) – можно получить металлические производные.
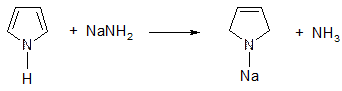
Реакциям электрофильного замещения подвержены б – углеродные атомы.
Шестичленные гетероциклы
Пиридин и его метильные производные – б, в и г – пиколины получают в основном из каменноугольной смолы.
Можно синтезировать конденсацией б, в – ненасыщенных альдегидов с аммиаком:
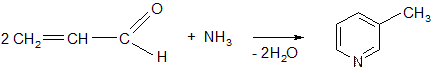
в – пикалин
Свойства
Пиримидин гораздо хуже вступает в реакции электрофильного замещения, чем бензол и даже нитробензол (можно пронитровать, бромировать и сульфурировать, но с очень плохим выходом), но в в – положение:
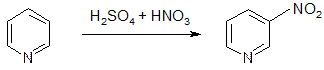
- действует как заместитель второго рода – ориентирует в м-положение, причем уменьшает способность электрофильного замещения, особенно нитрования и сульфирования, поскольку в кислой среде (пиримидин – основание) – превращается в соль, на N+ - положительный заряд, и поэтому N+ является еще более электроакцепторным и, следовательно, пассивирующим ядро к электрофильным атомам.
С другой стороны, атом N, как заместитель второго рода, направляет реакцию нуклеофильного замещения в б и г – положения:
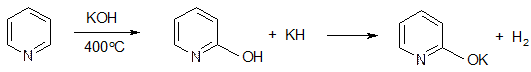
Противоопухолевые производные этиленимина
Общая формула
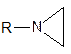
Фармакологическая активность обусловлена цитостатическим действием (угнетает деление клеток).
Цитостатический эффект объясняется алкилирующим действием высокореакцион-ного этиленимина на нуклеопротеиды (взаимодействует с нуклеопротеидами) – ингибируется деление клеток. Большинство клеток организма делятся очень редко, - их деление строго контролируется. Деление опухолевых клеток безконтрольно, они делятся очень быстро, поэтому опухолевая ткань очень быстро растет. Следовательно, производные этиленимина будут ингибировать опухолевый рост, не влияя на медленно делящиеся клетки.
Побочное действие: эти препараты тормозят рост всех тканей, клетки которых быстро делятся – эпителиальные клетки желудка и кишечника, кровотворные клетки костного мозга и т. д. Кроме того, некоторые препараты могут взаимодействовать и с протеидами – ферментами, дезактивируя их, тем самым вызывая нарушения в организме.
Синтез
Наибольшее число применяемых препаратов – производные фосфорной или тиофосфорной кислоты с общей формулой:
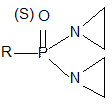
Этиленимин синтезируют циклизацией хлорэтиламина - в-галогенамина
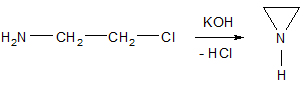
- нагревают до 50оС в присутствии КОН.
В медицинской практике применят много препаратов, мы рассмотрим три из них, наиболее часто применяемые: тиофосфамид, тиодиним, имифос.
 2015-07-14
2015-07-14 1176
1176








