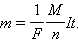Ток, индуцируемый при изменении магнитного поля проходящего через контур, своим магнитным полем препятствует этому изменению.
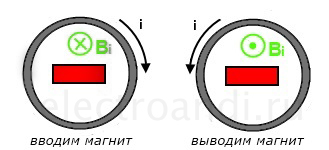
В том случае, когда мы вводим магнит в катушку, магнитный поток в контуре увеличивается, а значит магнитное поле, создаваемое индуцируемым током, по правилу Ленца, направлено против увеличения поля магнита. Чтобы определить направление тока, нужно посмотреть на магнит со стороны северного полюса. С этой позиции мы будем вкручивать буравчик по направлению магнитного поля тока, то есть навстречу северному полюсу. Ток будет двигаться по направлению вращения буравчика, то есть по часовой стрелке.
В том случае, когда мы выводим магнит из катушки, магнитный поток в контуре уменьшается, а значит магнитное поле, создаваемое индуцируемым током, направлено против уменьшения поля магнита. Чтобы определить направление тока, нужно выкручивать буравчик, направление вращения буравчика укажет направление тока в проводнике – против часовой стрелки.
1. Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
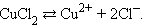 |
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4(медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
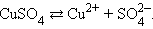 |
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион 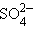 отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом:
отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом:
| SO4 + Cu = CuSO4. |
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
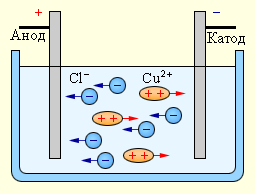 |
| Рисунок 1.15.1. Электролиз водного раствора хлорида меди |
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
|
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
 |
Здесь m 0 и q 0 – масса и заряд одного иона, 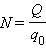 – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m 0 иона данного вещества к его заряду q 0.
– число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m 0 иона данного вещества к его заряду q 0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q 0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
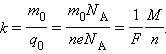 |
Здесь N A – постоянная Авогадро, M = m 0 N A – молярная масса вещества, F = eN A – постоянная Фарадея.
| F = eN A = 96485 Кл / моль. |
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
|
Явление электролиза широко применяется в современном промышленном производстве.
2. Электрический ток в электролитах.
Закон электролиза. Вещества, растворы которых проводят электрический ток, называются электролитами. Вода и кристаллы хлорида меди практически не проводят электрический ток. Раствор хлорида меди в воде является хорошим проводником. При прохождении электрического тока через водный раствор хлорида меди у положительного электрода, называемого анодом, выделяется газообразный хлор. На отрицательном электроде, называемом катодом, выделяется медь.
Изменение химического состава раствора или расплава при прохождении через него электрического тока, обусловленное потерей или присоединением электронов ионами, называется электролизом.
Фарадей установил, что при прохождении электрического тока через электролит масса m вещества, выделившегося на электроде, пропорциональна заряду, прошедшему через электролит:
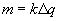 , (47.1) или
, (47.1) или 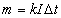 , (47.2)
, (47.2)
где I — сила тока; — время пропускания тока через электролит.
Выражения (47.1) или (47.2) называются законом электролиза. Коэффициент пропорциональности k в этих выражениях называется электрохимическим эквивалентом вещества.
Механизм электролиза. Особенностью молекул электролитов является перераспределение электрических зарядов, в результате которого одна часть молекулы вещества электролита оказывается заряженной положительно, другая — отрицательно. Разноименно заряженные части молекулы связываются кулоновскими силами притяжения.
При растворении электролита в жидкости, например хлорида натрия в воде, взаимодействие молекул жидкости с молекулами электролита ослабляет связь между частями молекул электролита и некоторые из них разделяются на положительный и отрицательный ион. Разделение молекул электролита на ионы происходит за счет энергии теплового движения молекул. В электрическом поле ионы электролита приходят в движение: положительные ионы движутся к катоду, отрицательные — к аноду. Так возникает электрический ток в электролите. При встрече положительного и отрицательного ионов происходит их соединение — рекомбинация. Сила взаимодействия ионов в воде уменьшается в 81 раз (диэлектрическая проницаемость воды), и это затрудняет процесс рекомбинации ионов. При повышении температуры электролита возрастает средняя кинетическая энергия теплового движения молекул, увеличивается и число пар ионов, образующихся в единицу времени.
Из-за увеличения концентрации ионов при повышении температуры значение электрического сопротивления электролита с повышением температуры уменьшается.
Примером твердого электролита может служить стекло, в котором имеются ионы натрия. При низких температурах перемещение ионов в стекле затруднено и стекло является хорошим изолятором. При нагревании стекла до 300—400 °С ионы получают возможность перемещаться под действием электрического поля и стекло становится проводником электрического тока.
Электрический ток в любых электролитах создается движением положительных и отрицательных ионов, т. е. заряженных атомов или молекул вещества.
Применение электролиза. Явление электролиза широко применяется в современном промышленном производстве. С помощью электролиза из солей и оксидов получают многие металлы, например медь, никель, алюминий. Электролитический способ дает возможность получать вещества с малым количеством примесей. Поэтому его применяют для получения многих веществ, когда требуется высокая степень химической чистоты.
Путем электролиза можно наносить тонкие слои металлов, например хрома, никеля, серебра, золота, на поверхность изделий из других металлов. Эти слои могут служить защитой изделия от окисления, повышать его прочность или просто украшать изделие. Электролитический способ покрытия изделий тонким слоем металла называется гальваностегией.
При более длительном пропускании тока через электролит можно получить на изделии такой толстый слой металла, который может быть отделен от него с сохранением формы. Электролитическое получение точных копий различных изделий называется гальванопластикой. С помощью гальванопластики получают копии изделий сложной формы, копии скульптур и других произведений искусства.
Явление электролиза лежит в основе принципа действия кислотных и щелочных аккумуляторов, где используется важное свойство процесса электролиза — его обратимость.
 2015-07-14
2015-07-14 875
875