5. Раствор HBr не взаимодействует с раствором вещества, формула которого...
А) LiOH; Б) TlNO3; В) CaCl2;...
Решение.
А) HBr + LiOH → LiBr + H2O.
Р, сильный Р, слабый
Среди продуктов реакции между растворами HBr и LiOH есть слабый электролит H2O, значит, раствор HBr взаимодействует с раствором LiOH. Это неверный ответ.
Б) HBr + TlNO3 → HNO3 + TlBr
Р, сильный М
Среди продуктов реакции между растворами HBr и TlNO3 есть малорастворимое вещество TlBr, значит, раствор HBr взаимодействует с раствором TlNO3. Это неверный ответ.
В) HBr + CaCl2 → CaBr2 + HCl.
Р, сильный Р, сильный
Среди продуктов реакции между растворами HBr и KOH нет ни слабых электролитов, ни малорастворимых или нерастворимых веществ, значит, раствор HBr не взаимодействует с раствором CaCl2. Это верный ответ.
ОВР
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ.
1. В простых веществах степени окисления равны нулю, например, Сu0.
2. Некоторые элементы в сложных веществах и в ионах имеют, как правило, постоянные степени окисления, в частности:
а) у элементов I (исключения − Cu+2, Au+3), II и III групп периодической системы степень окисления, как правило, равна номеру группы со знаком «+», например, K+1NO3, Be+2SO4, Al+3F3;
б) у H степень окисления, как правило, равна +1, например, H+1Br;
в) у O степень окисления, как правило, равна −2, например, CCl2O–2 (исключение − H 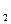 O
O 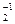 )
)
г) у F степень окисления всегда равна −1, например, HF–1.
3. У атомов кислотных остатков в солях степени окисления такие же как в кислотах, например, в хлоридах MCl x – степень окисления хлора −1, Cl–1; в сульфатах M a (SO4) b – степень окисления серы +6, S+6; в нитратах M(NO3) x – степень окисления азота +5, N+5.
4. Сумма степеней окисления всех атомов в молекуле (формульной единице) вещества равна нулю.
 2015-07-14
2015-07-14 368
368








