Растворы – гомогенные смеси переменного состава. Растворы состоят из растворенного вещества и растворителя. Растворителем называют компонент, который сохраняет свое фазовое состояние при образовании раствора и его концентрация выше концентрации других компонентов. Концентрация раствора указывает на количественный состав раствора.
Существует несколько способов выражения концентрации растворов.
1. Массовая доля вещества w - показывает массу растворенного вещества в 100 г раствора:
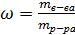 ,
,
где mв-ва – масса растворенного вещества, г;
m р-ра – масса раствора, г;
m р-ра = mв-ва + m р-ля
Массовая доля может быть выражена в процентах – процентная концентрация:

Например, 5 % - ный раствор NaCl, значит в 100 г раствора содержится 5 г NaCl, а для приготовления 100 г 5 % - ного раствора необходимо 5 г NaCl растворить в 95 г воды.
2. Молярная концентрация вещества См – показывает количество моль растворенного вещества в 1 литре раствора, размерность моль/л или М:
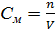 ,
,
где n – количество моль растворенного вещества, моль;
V – объем раствора, л.
Например, для приготовления 0,5 М раствора NaNO3 необходимо 0,5 моль вещества поместить в мерную колбу на 1 л, растворить в небольшом количестве воды, далее объем раствора довести до метки.
3. Эквивалентная концентрация или нормальная концентрация Сн – показывает количество моль – эквивалентов растворенного вещества в 1 литре раствора, размерность моль – экв/л или н:
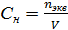 ,
,
где nэкв – количество моль – эквивалентов растворенного вещества, моль – экв;
V – объем раствора, л.
Например, для приготовления 0,5 н раствора Ca(NO3)2 необходимо 0,5 моль - эквивалентов вещества поместить в мерную колбу на 1 л, растворить в небольшом количестве воды, далее объем раствора довести до метки.
4. Мольная доля, c – величина, показывающая отношение количества молей данного вещества ni к общему количеству молей всех веществ, находящихся в смеси или в растворе
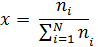
5. Моляльная концентрация, Сm, показывает количество моль растворенного вещества, находящегося в 1 кг растворителя, моль/кг
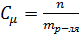 ,
,
где n – количество моль растворенного вещества,
m р – ля – масса растворителя, кг
Например, для приготовления 0,5 моляльного раствора хлорида магния необходимо 0,5 моль вещества растворить в 1 кг воды
6. Титр раствора, Т – масса вещества в 1 мл раствора, г/мл
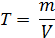
Все концентрации взаимосвязаны друг с другом, значит, зная, например, молярную концентрацию раствора, можно легко получить моляльную или эквивалентную концентрацию раствора.
 2015-08-13
2015-08-13 438
438








