Вода, являясь весьма слабым электролитом, в очень малой степени диссоциирует на ионы:
Н2О «Н+ + ОН-
Данный равновесный процесс описывается константой равновесия:
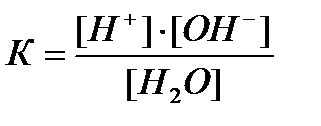
где К – константа диссоциации воды. При 220С она равна 1,8 ∙ 10-16.
Так как степень диссоциации воды очень мала, то в уравнении (1) концентрацию воды [Н2О] можно считать величиной постоянной
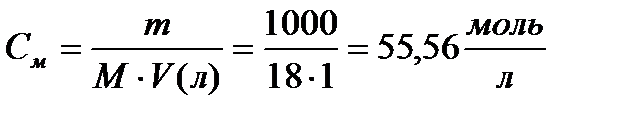 ,
,
тогда
[H+]×[OH-] = K [H2O]=Kw,
где Кw – ионное произведение воды.
Подставляя значения К и [Н2О] в уравнение (2), получим численное значение ионного произведения воды при 220С.
Kw = [H+][OH-] = 1,8 ∙ 10-16 ∙ 55,56 = 10-14
Зависимость КW от температуры демонстрируется следующими данными:
t, C0 10 22 30 50 100
КW 0,36 × 10-14 1,00 × 10-14 1,89 × 10-14 5,6 × 10-14 74 × 10-14
Таким образом, КW- величина постоянная лишь при данной температуре.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При 220С в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна 10-7 моль/л. В кислых растворах больше концентрация ионов водорода, в щелочных – концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид – ионов остается постоянным.
|
|
|
Отсюда следует, что степень кислотности и степень основности раствора можно выразить с помощью концентраций ионов H+ или OH-:
Нейтральный раствор [H+] = 10-7 моль/л,
Кислый раствор [H+] > 10-7 моль/л,
Щелочной раствор [H+] < 10-7 моль/л.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
рH = -lg[H+] или [Н+] = 10-рН
где [Н+] - концентрация ионов водорода, моль/л.
Гидроксильным показателем рОН называют десятичный логарифм концентрации гидроксид-ионов, взятый с обратным знаком:
рОН = - lg [OH-] или [ОН-]=10-рОН
где [ОН-] - концентрация гидроксид-ионов, моль/л.
Тогда
рН + рОН=14; рОН=14 - рН.
Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой

Из схемы видно, что чем меньше рН, тем больше концентрация ионов Н+, т.е. выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
 2015-08-13
2015-08-13 2690
2690








