Основой любого фермента является белок, представляющий собой компактную конструкцию из одной или нескольких полн-пептидных цепей, ковалентно связанных (сшитых) дисульфид-иыми мостиками. Помимо белка ферменты иногда могут содержать и небелковые компоненты: простетическне группы неорганической и органической природы, лип иды (в ли по протеидах) и углеводы (в гликопротеидах). Конечно» в общем случае химические методы иммобилизации нацелены на модификацию функциональных групп в белковой части молекулы фермента. Однако при выборе процедуры иммобилизации для конкретного фермента целесообразно учитывать и специфические особенности строения его молекулы. В этой связи укажем на хорошо известный и яркий пример ковалентной иммобилизации гл и ко протеидов. Относительно простым методом — окислением периодатом натрия в мягких условиях — в полисахарндную часть фермента вводятся альдегидные группы, посредством которых на следующем этапе и осуществляется химическое изаимпдействие с носителями или сшивающими агентами, содержащими аминогруппы (образованием азомети новых связей, оснований Шиффа).
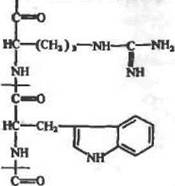
Белковые части ферментов построены (рис. 13) из ~20 аминокислот, соединенных между собой пептидной связью. Количество аминокислотных остатков в полилелтндных цепях белков составляет от нескольких десятков до тысяч. Однако качественный состав белков (содержание тех или иных аминокислотных остатков) оказывается весьма сходным. Почти половину всех аминокислотных остатков белка составляют аминокислоты с неполярными или слабополярными боковыми группами. В резуль-

 |
P-S)
 2015-08-13
2015-08-13 788
788








