7В
|

|
| (Ф) |
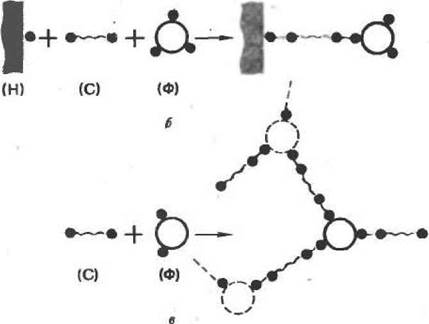
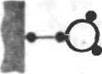
Рис. II, Блок-схемы ковалентной иммобилизации ферментов
за счет сшивающегося агента, этот способ несравнимо богаче и гибче предыдущего. Во-первых, подбором длины сшивающего агента (или подбором оптимальной смеси сшивающих агентов различной длины) можно изменять каталитические характеристики иммобилизованного фермента. Во-вторых, можно специально конструировать сшивку так, чтобы она содержала связь, лабильную в определенных условиях или специфически расщепляемую определенными реагентами (в частности, фер-ментативно). Это дает ключ к контролируемому отделению иммобилизованного фермента от носителя, например, при решении проблем направленного транспорта ферментов в живом организме.
Целый ряд разнообразных решений задачи ковалентной иммобилизации ферментов дает использование систем, изначально не содержащих носителя, а только фермент и сшивающие агенты, где носитель {как твердое тело) формируется непосредственно в процессе иммобилизации или же сам фермент служит одновременно и носителем. Речь, таким образом, пойдет здесь о ковалентном вшивании молекулы фермента в различные типы сеток (рис. II, в). Идея конструирования ферментных сеток (ретикуляция ферментов) вытекает из «олифу нкиионалышй природы самой молекулы фермента, имеющей на поверхности по-
мимо активного центра достаточно большое количество реак-ционнеспособных групп. При введении в раствор фермента бифункционального сшивающего агента отдельные молекулы фермента сшиваются друг с другом и образуют более или менее сложные агрегаты сетчатой структуры, е которой узлами служат сами молекулы фермента. В зависимости от природы и количества сшивающего агента можно получить как водорастворимые, так и водонерастворимые препараты.
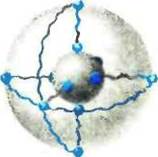
Другой прием ретикуляции основан на использовании ферментов, предварительно ковалентно модифицированных реагентом, содержащим двойную связь, например акрилоштхлоридом, В этом случае при сополимернзации белкового макромономера с низкомолекулярными мономерами (например, с акрил амидом) образуются сетчатые полимерные гели, сшитые белком или дополнительным сшивающим мономером (например, NT N-мети-лен-бис-акриламидом). В рассматриваемой системе исходное состояние — жидкий раствор, а конечное (после полимеризации) — твердое тело (гель), причем, естественно» оно приобретает форму того сосуда (реактора), в котором проводится полимеризация. Целенаправленное использование этого явления положено в основу целого ряда оригинальных способов иммобилизации. Сшивкой белка в объеме растворителя (сополи-меризацией) получают трехмерный гель (рис. 12, а) в виде крупного однородного блока, который можно механически измельчать и использовать в виде более или менее мелких частиц в суспензиях. Трехмерный гель можно готовить и непосредственно в виде мелких частиц сферической формы путем эмульсионной полимеризации. Эмульсии получают диспергированием водного раствора, содержащего мономеры, в несмешивающемся с водой органическом растворителе. Предельный вариант таких систем — микроэмульсии, или гндратированные обращенные мицеллы поверхностно-активных веществ (ПАВ) в органических растворителях. В мицеллярыых системах размеры «капелек», содержащих модифицированный фермент и мономеры, можно варьировать и даже получать их близкими к собственным размерам молекул ферментов. Это новое качество иммобилизации — молекулярный уровень. Иными словами, при использовании систем обращенных мицелл ПАВ в органических растворителях, можно обшивать отдельные молекулы фермента полимерной оболочкой заданной толщины, т. е. в полном смысле одеть фермент в «рубашку, сшитую по мерке» (рис. 12,6).
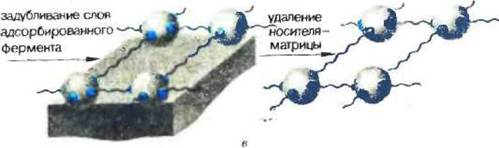
Процесс ретикуляции может быть реализован не только в растворе фермента, но и при использовании его иммобилизованных препаратов. Так, в случае фермента, предварительно иммобилизованного на химически инертном носителе путем физической адсорбции, дополнительная обработка сшивающим агентом приведет к повышению прочности (задубливанню) препарата. Носитель здесь непосредственно не принимает участия в химической реакции — он служит лишь матрицей для организации

|
Однородном растворе
|
химическое

|
введение е' молекулу фермента скойои"
Рис, 12. Типы ретмкуляции ферментов:
а - межмолекулярная трехмерная (етка; б — сетчатая оболочка вокруг молекулы фермента (молекулярна иммобилизованный фермент); в- дв>мернзм сетка; г — внутримолекулярная сетка из полипептидных цепей белка и химических «скобок»
слоя (монослоя) адсорбированного фермента и обусловливает двумерную направленность ретикуляции. Более того, носитель может быть вообще удален (например, нитроцеллюлозу растворяют в метаноле) и, таким образом, получится сшитая ферментная пленка (рис. 12, з).
В принципе можно представить себе «нульмерную» ретикуля-
дню, поскольку являющаяся узлом ферментной сетки молекула фермента — это не условная точка, а довольно-таки крупный объект. Иными словами, от сеток межмолекулярых перейдем к внутримолекулярным, составленным нз полимерных цепей белка и химических сшивок. Один из примеров такого рода был уже рассмотрен (рис. 12,6). Добавим, что препараты молеку-лярно иммобилизованных ферментов могут быть получены, если обе группы бнфункионального сшивающего реагента проезаимо-действуют с одной и той же молекулой белка. В таком случае (рис. 12, г) речь идет о наложении «химических скобок», внутри-молекулярно закрепляющих структуру фермента. Практическая реализация этого подхода в гомогенном растворе затруднена из-за образования наряду с внутримолекулярными межмолекулярных сшивок. Исключить меж молекулярные взаимодействия можно путем перехода от гомогенных к микрогетерогениым системам с пространственно изолированными молекулами фермента, например солюбилнэациеи ферментов в органических растворителях с помощью гндратированных обращенных мицелл ПАВ.
 2015-08-13
2015-08-13 452
452








