\4*еакции образования амидной связи |—С(О)—NH—]. Присоединить белок (Ф) к носителю (Н) или сшивающему агенту (С) посредством амидной связи можно многими путями и при участии различных функциональных групп. Наиболее часто применяется реакция ацилирования аминогрупп фермента. В качестве ацили-рующих агентов широко используются ангидриды:
 |
CD
и хлорангидриды карбоновых кислот:
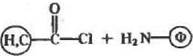 |
рЦ>7гО; 4°С
(Й^—С—NH—@
В случае ангидридного метода в непосредственной близости от возникшей амидной связи в препарате иммобилизованного фермента оказывается карбоксильная группа, образующаяся в ходе
№
реакция (1). Это обстоятельство следует учитывать как с точки зрения ее возможного влияния на баланс электростатических взаимодействий в белке и направления локального смещения рН, так и с точки зрения химический стабильности иммобилизоиан-ного препарата: в кислой среде карбоксильная группа может катализировать гидролиз амид но и связи в конъюгате.
В качестве ацилирующих агентов также могут выступать активированные эфиры (или другие производные карбоновых кислот с хорошими уходящими группами), например /ьнитрофенило-вые эфиры:
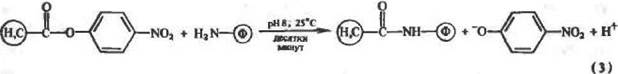 |
Реакция (3) замечательна тем, что в процессе модификации белка высвобождается ннтрофенолят-нон (р/С = 7), удобная хромофорная метка для строгого контроля за ходом реакции спектрофотометр и ческим методом.
Реакционная способность активированных производных кар-боновых кислот падает по мере уменьшения кислотности уходящей группы (от хлор ангидридов до эфиров).
Перечисление ацилирующкх агентои можно было бы продолжить и рассмотреть, например, реакции с ацилазидами, образующимися из гидразидов карбоновых кислот при их обработке азотистой кислотой. Однако новыми здесь будут лишь методы (более сложные) подготовки носителей и сшивающих агентов, тогда как суть проведения самого процесса иммобилизации и тип образуемой связи в конъюгате будут аналогичны тем, которые характерны реакциям (I)— (3).
Принципиально иные реагенты и реакции могут быть заимствованы, например, из такой хорошо разработанной области органической химии, как пептидный синтез, центральной задачей которого является образование амидных связей. В качестве удобных ацилирующих агентов в пептидном синтезе используют производные О-ацклиэомочевнны:
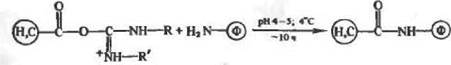 |
+ R—NH—С—NH—R* {*)
Реакция (4) отражает взаимодействие аминогрупп фермента с носителем или сшивающим агентом, содержащими карбоксильные группы активированные карбодиимндом, R — N=C=^N—R. Ииыми словами, карбодинмнд служит конденсирующим агентом н равным образом осуществляет реакцию образования амид ной связи за счет активированных карбоксильных групп белка и аминогрупп носителя или сшивающего реагента. Ниэкомояекуляр-ные карбодиимиды сами по себе могут рассматриваться как своеобразные сшивающие агенты. Дело в том, что обработка
белков такими карбодиимидами может приводить к образованию межмолекулярных и внутримолекулярных амидных связей между карбоксильными и аминогруппами белковых молекул: при этом исходный карбодиимид превращается в соответствующее производное мочевины и не входит в состав возникшего белкового конъюгата. В пептидном синтезе главным образом находит при-менение днциклогексилкарбодиимид, при трансформации которого образуется дициклогексилмочевина — труднорастворимое в воде вещество и поэтому легко отделяемое от водорастворимых целевых продуктов. Это обстоятельство создаёт определенные неудобства при необходимости иммобилизации ферментов на твердых носителях. Указанный недостаток устраняется при использовании растворимых карбодиимидов, имеющих гидрофильные и (или) заряженные группы в боковых радикалах R и R', например, 1-циклогексил-3-[2-морфолино-(4)-этил]-карбодиимид - ме-топ-тол уолсульфонат
 |
СеН,,— N=C=N—
СН3
Другой пример конденсирующего агента, достаточно широко употребляемого для ковалентной иммобилизации ферментов путем образования амидной связи, также заимствован из пептидного синтеза — это изоксазолиевая соль, реактив Вудворда:
 |
| ООН |
 SOJ
SOJ
-о
L
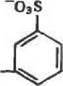 |
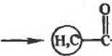 |
| Н—О—С- |
-NH-ЧФ)
(5)
Условия проведения реакции {5) с реактивом Вудворда в общем близки к условиям проведения реакции (4) с карбодиими-дами, разница лишь в том, что в случае реакции (5) применимы и слабощелочные среды. Добавим также, что реакция (5) протекает весьма энергично и в ряде случаев при использовании реактива Вудворда, особенно при его избытке, обнаруживается инактивация ферментоь (например, креатинкиназы и гексокинаэы). У Реакции образования карбамндных связей (производных мочевины: — (NH, О)—С(О, S)—NH—). Химик мочевины, ее предшественником и производных чрезвычайно богата и разно-
образна по реакциям. Именно синтезом мочевины из цнановокислого аммония, осуществленным Ф, Велером в 1828 г., было положено начало современной препаративной органической химии. Приведенный пример вполне здесь уместен-» поскольку аналогичная реакция может быть с успехом использована для ковалентной иммобилизации ферментов.
Изоцианаты, RNCOT способны эффективно взаимодействовать с различными функциональными группами белкой с образованием производных мочевины, таких, как диалкилмочевииы, уретаны и у рейды. Наиболее pea кцион неспособны ми группами белков по отношению к изоцнанатам являются аминогруппы:
 |
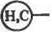 |
| ■N=C=O + H2N—(Ф) |
I
Аналогичным образом могут быть применены иэотиоцианаты. При этом, соответственно, образуются производные тиомочевины. ■ Одним из самых распространенных методов активации природных полисаха рид ных носителей (или синтетических пол иолов) является бромциаковын метод. При обработке бром цианом на таких носителях формируются исключительно реакционноспо-собкые, цианатные, —О—C^N, и имидокарбонатные,
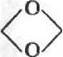 |
| C=NH, группы. При взаимодействии белка с таким обра- |
эом активированным носителем образуются изомочевины (7) и уретаны (8):
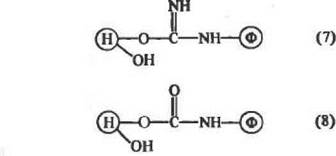 |
| J^-4 pH 7; 4"С / |
Полиольные носители (в том числе полисахариды) активируют также алкйлхлорформиатамн, при этом получают циклические карбонаты, эффективно взаимодействующие с аминогруппами белков:
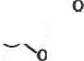 |
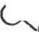 |
| HY^ '^C—0 + НаМ~<Ф) |
При обработке нитрилов, например лолиакрилиитрнла, хлорводо-родом и спиртами в безводной среде получают хлоргидраты ими-доэфиров:
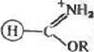 |
cr
Имидоэфиры могут быть также синтезированы при алкилировании (диметилсульфатом) амидной группы, например, в полиамидах. В свою очередь они легко реагируют с аминогруппами белков с образованием амидинов:
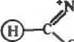 |
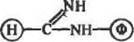 |
| н,сг |
рНТ-9;4*С
Чкы
«яэи
В случае реакции с ншдоэфирами (10) образующаяся в конъю-гате связь химически более прочная, чем в (7) — (9), Дело в том, что характерная особенность конъюгатов, получаемых по реакциям (7) — (9), заключается в возникновении соединительной группировки уретанового типа, т. е, содержащей сложноэфирную связь. Эта связь может расщепляться под действием нуклеофнль-ных реагентов, в том числе под действием аминогрупп белков:
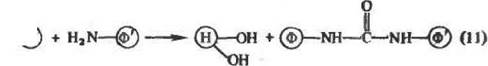 |
L
Эта реакция может быть положена в основу получения сшитых димерон белков или их субъединии (одинаковых или разных) либо ею можно воспользоваться для удалений иммобилизованного фермента с носителя. В том же случае, когда отщепление иммобилизованного белка от носителя крайне нежелательно, следует исходить из других типов носителей, например носителей, содержащих вместо гндроксильных групп аминогруппы.
^■/Реакции образования вторичных аминов (связи —NH—), Первичные а- и е-аминогруппы белков могут быть трансформированы во вторичные в реакциях алкилирования и арилирования, а также путем восстановлений азомегиновых связей (оснований Шиффа). Если в качестве ал копирующих или арилирующих агентов использовать соответствующие носители и сшивающие агенты, то образуются конъюгаты, в которых белковая часть фермента закреплена прочной, негидролизуемой азот-углеродной связью, причем вторичный амин легко протонируется ит таким образом, может нести на себе положительный заряд так же, как исходная аминогруппа.
Хорошо известными алкилирующими и арилирующнми агентами служат галогенпроизводные алифатических и ароматических углеводородов, а также метилкетонов- Взаимодействие носителей и сшивающих агентов, содержащих активный атом галогена при атоме углерода, с ферментами протекает по схеме {12)
:н,—а
(12)
в щелочной среде, требующейся для депротоннрования аминогруппы и связывания образующегося хлорида водорода. В этих условиях алкнлируются также тирльные группы цнстеина, ими да-зольные — гнстндина, гидроксильные —- тирозина и, в меньшей степени, алифатические гидроксильные группы белка. В качестве арнлирующих агентов, помимо галогенпроизводных, могут быть применены и сульфопроиз водные. Однако в последнем случае наряду с реакцией алкнлнрования может протекать и реакция сульфирования аминогрупп белка с образованием сульфамидной связи.
В общем число алкилкрующнх и ацнлирующих агентов очень большое. Но особого упоминания заслуживает метод, использующий хлорпроизводные I Д5-триазнна, в частности цнанурхло-рид, из-за его простоты н надежности. В цнанурхлориде три атома хлора связаны с атомами углерода. В присутствии соединений с HS-, H2N- и НО-группами происходит быстрое расщепление одной из трех С—СI-связей, затем (более медленно) подвергается расщеплению и вторая группа, а третья обычно в реакции арнлн-рования участия не принимает (время иммобилизации около суток при 4°С). Циа нурхлорид может быть с успехом применен для активации носителей, например полисахаридов, а также как бифункциональный сшивающий или вшиваемый агент.
Исключительно эффективными алкилнрующнми агентами являются такие производные олефинов, как и мины, оксиды и тио-оксиды {оксираны и тнираны):
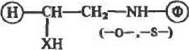 |
(13>
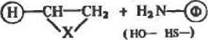
где X =:>NH,>O,>S
Реакцию (13) можно проводить в средах с различными значениями рН, причем от выбора рН существенно зависит на прав-леи не реакции: по амино- или оксигруппам белка.
Реакции как алкилнронання, так и арилирования можно провести путем присоединения фермента (посредством его тнольных, амино- и гидроксильиых групп) по активированным двойным связям. Для этой цели используют гидроксилсодержащие носи-тели, предварительно активированные дивинилсульфоном или бензохнноном. Процесс иммобилизации можно представить, соответственно, схемами (14) и (15):

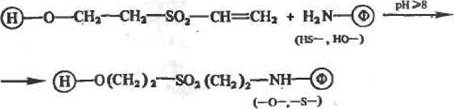 |
(14)
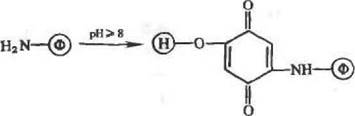 |
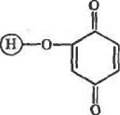 |
05)
Реакции активации носителей бензохиноном и последующего присоединения к таким носителям фермента правильнее было бы называть окислительным арнлированнем, поскольку в качестве промежуточных группировок в них образуются^ гидрохиноновые, которые, в свою очередь, окисляются хнноном или растворенным кислородом воздуха (среда щелочная, что благоприятствует процессу окисления).
Если теперь вернуться к рассмотренным реакциям (I)—(15), то можно констатировать, что все эти реакции в общем-то неспецифические и помимо аминогрупп в них могут принимать участие, как это уже отмечалось, другие функциональные группы: тиояь-ные, имидазольные, гидрофильные. Одним из наиболее распространенных методов специфической модификации аминогрупп белков является образование азометнновых связей, — CH=N—, в реакциях белков с альдегидами (16):
 |
| —N- |
(16)
Продукты конденсации амино- и альдегидсодержащих соединений — основания Шиффа — образуются легко и быстро в щелочных средах и в этих условиях весьма стабильны. Особенно широкое распространение в методах иммобилизации получили диальдегиды, такие, как глутаровый альдегид, используемый в качестве сшивающего агента. При применении ннзкомолеку-лярных альдегидов, в том числе глутарового, необходимо учитывать возможность образования разнообразных побочных продуктов полимеризации и пол и конденсации уже в исходных реагентах. В результате при действии глутарового альдегида на фермент помимо оснований Шиффа могут возникать и другие конъюгаты, в том числе связанные через вторичные амины.
Характерной особенностью азометиновой связи является то, что она легко разрушается в кислых средах с регенерацией исходных веществ реакции (16). Это ее свойство может использоваться для удаления с носителя ковалентно иммобилизованного фермента путем простого изменения рН среды. Очевидно также, что азоме-тиновая связь непригодна для ковалентной иммобилизации фер ментов, предназначенных для работы в кислых средах. Однако устойчивости конъюгатов с азометиновой связью к кислотам можно добиться путем восстановления згой группировки:
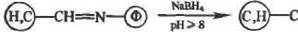 |
| Н,—NH- |
(17)
Реакция (17) приводит к образованию вторичного амина, прочной ко валентной связующей группировки между белком и носителем или сшивающим агентом.
Взаимодействие альдегидных и аминогрупп можно осуществить и таким образом, чтобы сразу (в один прием) получить прочный конъюгат. Примером такого процесса служит метод Уги, который схематически может быть представлен реакцией (18):
Ж ХН
+ R,—С(О>—N(R2)—CH{R3)—C(O)— NH—R4 (18)
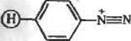
Как видно из схемы, помимо альдегидных и амннных групп в реакцию (18) вступают соединения с карбоксильной группой и изо нитрилы с образованием амид ной связи между белком и носителем. Иными словами, по методу Уги ферменты можно ко валентно иммобилизовать на носителях, содержащих альдегидные группы, в присутствии изоцианатов как по амино-, так и карбоксильным группам. Равным образом иммобилизация может быть осуществлена на носителях, содержащих изонитрильные группировки о присутствии низкомолекулярных альдегидов. \ЙРеакции азосочетання (образование азосоедннеинй со связью —-и —N—). Соли диазония [Аг—N=N1 + C1~ способны вступать в различные реакции сочетания, скорость которых и направление существенно зависят от рН среды и природы ароматического субстрата. В реакциях ааосочетания могут, в принципе, участвовать а минные, гуаниднновые, тнольные, имидазольные и фенольные группы белков, причем в ряде случаев с одной функциональной группой могут реагировать две диазогруппы.
В слабощелочной среде основной группой-мишенью в белке является фенольный радикал тирозина (атаке ионом диазония в этих условиях может также подвергаться незащищенный незаряженный имидазол гнетидина):
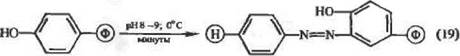 |
 |
В результате реакции (19) быстро образуется прочный конъюгат белка с носителем, связанный через диазогруппу. Важно отметить простоту процедуры иммобилизации этим методом, несложным также является получение соли диазония при работе с носителем (или сшивающим агентом), содержащим п-амннофепильные функциональные группы. Добавим, что комбинацией различных химических приемов можно вводить аминофенильные группы в разнообразные носители, например в полистирол и даже в полнакри-явмид.
N/Реакции тнол-дмсульфидного обмена (образование дисульфид ной связи» —S —S—). В предыдущем разделе было отмечено, что свободные сульфгидрильные группы в белках встречаются
УЗ
доволно-такн редко из-за ярко выраженной способности к окислению и образованию в нативных условиях дисульфидных мостиков — сшивок, которые, однако, в белках нетрудно восстановить до исходных сульфгидрильных групп- Способность к созданию дисульфидных мостиков может быть использована для ковалент-ной иммобилизации ферментов путем формирования межмолекулярных дисульфидных связей по реакции (20):
-SH + HS— ® [Р| ■ @h~S—S—(ф) (20)
Окисление сульфгидрильных групп до дисульфидных протекает спонтанно под действием растворенного кислорода воздуха. С целью увеличения содержания тиольяых групп в исходном белке проводит восстановление дисульфидных связей подходящим восстановителем, например боргидридом натрия, меркаптоэтанолом, дитиотреитолом, цистеином или его производными. Однако реокис-ление тиолькых групп при проведении реакции (2Q) может приводить к образованию «неправильные внутримолекулярных дн-сульфидных мостиков в белке и, таким образом, сопровождаться существенной потерей каталитической активности иммобилизованного фермента. Содержание сульфгндрнльных групп в белке можно увеличить за счет введения эндогенных групп, т. е. тиолк-рованием. Для этого, избрав в качестве групп-мишеней аминогруппы белка, обрабатывают их подходящими ацнлнруюшими или алкилирующими реагентами, содержащими защищенную сульфгидрильную группу, например тиолактоном гомоцистеина. Пример указанного реагента интересен тем, что при его использовании в белке увеличивается содержание сульфгидрильных групп, тогда как число аминогрупп не изменяется (а- и Е-амино-группы белка образуют с реагентом амидную связь, однако реагент несет на себе собственную а-аминогруппу, а также сульфгид-рильную, формируемую при раскрытии лактонного кольца).
В общем случае удобным приемом ковалентной иммобилизации ферментов путем образования дисульфидных мостиков является исиользонание реакций тнол-дисульфидного обмена (при этом резко уменьшается вероятность закрепления «неправильных* дисульфидных внутримолекулярных мостиков в белке)-Суть этого процесса можно выратчить реакцией (21)"
R,— S—S^R2 + HS— R^Rl— S—S— Ra + HS — R2 (21)
где Ri. Ra и R3 могут представлять собой белок, носитель, сшивающий агент и (или) радикал низкомолекулярного тиола. Реак-ции тиол-дисульфидного обмена обычно происходят в сильно-кислой среде, но могут катализироваться тиольными анионами в нейтральных и щелочных растворах. Примером иммобилизации ферментов по реакции (21) может служить взаимодействие белка с носителем, содержащим дитионитробензойную группу:
оо
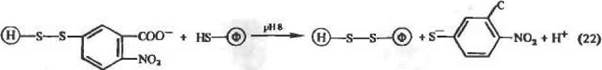
В этом методе присоединение фермента к носителю удобно контролировать спектрофотометрически (Я —412нм, е= 13 600) по количеству освобождающегося тионитробензоата.
Важным достоинством методов иммобилизации, основанных на реакции тнол-дисульфидногр обмена, является простота процедуры как присоединения фермента к носителю, так и отщепления (под дейстпием низкомолекулярного тиола).
Радикальные реакции (графт-сополкмернзация). Одним ил распространенных приемов получения синтетических полимерных материалов служит графт-сополимеризация, осуществляемая, например, путем химической прививки одного полимера к другому. Эта цель достигается при рекомбинации макрорадикалов, образующихся в исходной смеси полимеров при воздействии мощного источника -у-излученин. Нетрудно представить себе аналогичную ситуацию, когда п роли одного из компонентов смеси выступает биополимер, фермент. Однако жесткое облучение ферментов сопровождается, как правило, их необратимой инактивацией. Потери ферментативной активности могут быть существенно снижены при переходе к фотоиницннруемым реакциям. Примером фотореактивных агентов являются ал кил- и арила-эиды, которые, в свою очередь, могут входить в состав носителей или сшивающих агентов. При фотохимическом распаде таких соединений образуются молекулы азота и короткоживу-щие (0,1 —10 мс) высокореакционнеспособные радикалы — нит-рены:
R—N3 &. R—N + На
 2015-08-13
2015-08-13 1255
1255








