Задача №1. При определении кристаллизационной воды BaCI2•2H2O было получено 14,70% воды. Рассчитать ошибку абсолютную и относительную.
Дано: Решение:
BaCI2•2H2O 1. ω(ист H2O)= 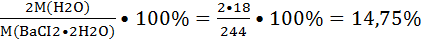
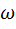 H2O% = 14,70 % 2. Δх абс.=14,75%-14,70%=0,05%
H2O% = 14,70 % 2. Δх абс.=14,75%-14,70%=0,05%
Найти: 3. Δх отн.= 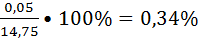
Δх абс. -? Ответ: Δх абс.=0,05%; Δх отн.= 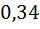 %
%
Δх относ. -?
Задача №2. Сколько мл. раствора КОН (ρ=1,291) требуется для приготовления 5 литров приблизительно 0,15 Н раствора.
Дано: Решение:
ρ (КОН)=1,291 1. Vисх= 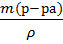
V(КОН)=5л.=5000 мл. 2. ω%= 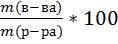
СN=0,15 Н m(р-ра)= 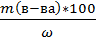
Найти: mэ(КОН) =  =56,11г/моль
=56,11г/моль
Vисх (КОН)-? 3. m(в-ва)= 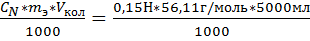 =42,08 мл.
=42,08 мл.
4. По таблице на стр.211 Ярославцева определить плотность ω=30%
m(р-ра)= 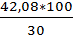 =140г.
=140г.
5. Vисх= 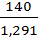 =108 мл.
=108 мл.
Ответ: Vисх=108 мл.
Задача №3. Какую навеску медного купороса CuSO4•5H2O следует взять для анализа на содержание кристаллизационной H2O.
Решение:
Хгр 0,1 гр.
CuSO4•5H2O → 5H2O
250 г/моль 5*18=90г/моль
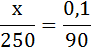
90х=0,1•250
90х=25
х=0,3
Ответ: х=0,3 гр.
Задача №4. Рассчитать навеску известняка для анализа на содержание СО2, если образец содержит около 85% СаСО3
Решение:
Х 0,1
СаСО3→СО2
100г/моль 44г/моль
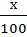 =
= 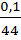
44х=10
х= 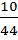 =0,23гр. (если СаСО3 чистый)
=0,23гр. (если СаСО3 чистый)
ωнав= 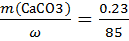 =0.3 СаСО3 c примесями
=0.3 СаСО3 c примесями
Ответ: m(нав)=0,3гр.
Задача №5. Рассчитать навеску кристаллической соды Na2CO3•10H2O для анализа на содержание кристаллизационной воды.
Решение:
Хгр 0,1гр.
Na2CO3•10H2O→10H2O
286,14г/моль 10*18=180г/моль
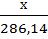 =
= 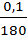
180х=286,14•0,1
Х= 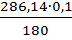 =0,16~0,2гр.
=0,16~0,2гр.
Ответ: х=0,2гр.
Задача №6. Какую навеску каменного угля, содержащего около 4% серы следует взять для анализа на содержание серы, если ее определяют в виде BaSO4.
Решение:
ω(S)= 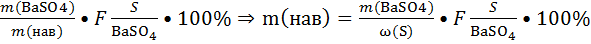
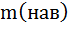 =
= 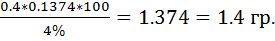
Ответ: 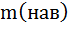 =1,4гр.
=1,4гр.
Задача №7. Для определения содержания влаги, взята навеска хлорида натрия 0,2828г. После высушивания до постоянной массы получено 1,9918г. Рассчитать содержание влаги Х в %.
Решение:
Определяем содержание влаги в Н2О
m(Н2О)=2.0828-1.9918=0.091 г.
2.0828 - 100%
0.091-х
Х= 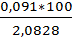 =4,37%
=4,37%
Ответ: х=4,37%
Задача №8. Рассчитать навеску Х кристаллического хлорида магния MgCI2•6H2O для определения в нем хлора, осаждением нитратом серебра.
Решение:
Х г
MgCI2•6H2O+2AgNO3→2AgCI↓+Mg(NO3)2+6H2O
2 моль 2 моль
203 г. 287 г.
Исходное вещество MgCI2•6H2O имеет М=95+108=203 г/моль, значит m=1 моль•203 г/моль=203 г.
Осаждаемая форма AgCI имеет
М(AgCI)=143.5г/моль
Масса осадка должна быть 0,5 г.
Составляем пропорцию:
для 287 г. AgCI масса осадка 0,5 г.
203 г. MgCI2 ------ Х г.
х= 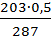 =0,35 г
=0,35 г
Ответ: х=0,35 г.
Задача №9. Рассчитать количество серной кислоты, необходимой для полного осаждения бария в форме сульфата из 0,5 г. кристаллического хлорида бария.
Решение:
0.5г. Х г.
BaCI2•2H2O + H2SO4→ BaSO4↓+2HCI+2 H2O
1 моль 1 моль
М(208+36) 98 г/моль
= 244,3г/моль 98 г.
BaCI2•2H2O 244,3 г. – масса 0,5 г.
H2SO4 98 г. – Х г.
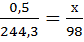 ; Х=0,2 г.
; Х=0,2 г.
Ответ: Теоретическое количество H2SO4 около 0,2 г, практический берут 0,3 г.
Задача №10. Технический хлорид бария содержит около 97% BaCI2•2H2O. Какую навеску следует взять для получения 0,3 г. осадка BaSO4.
Решение:
Х г. 0,3 г.
BaCI2•2H2O + H2SO4→ BaSO4↓+2HCI+2 H2O
244,3 г 233 г.
Х= 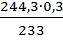 =0,31 г.
=0,31 г.
ω= 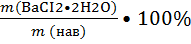
0,97= 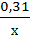
0,97х=0,31
Х=0,32 г.
Ответ: х=0,32 г.
Задача №11. Рассчитать навеску силикатной породы, содержащей около 5% СаО, которая необходима для определения кальция в виде СаSO4, если масса осадка СаSO4=0,3 г.
Решение:
СаО – определяемая форма
СаSO4 – весовая форма
Х г. 0,3 г.
СаО→ СаSO4
56 г. 136 г.
Х= 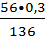 =0,124 г.
=0,124 г.
0,124 – 5%
Х – 100%
х=2,5 г.
Ответ: х=2,5 г.
Список используемой литературы
1. Ольшанова К.М., Пискарева С.К., Барашков К.М. Аналитическая химия. – М.: Химия,1990.
2. Попадач И.А., Траубенберг С.Е., Осташенкова Н.В., Лысюк Ф.А. Аналитическая химия. – М.: Химия, 1999.
3. Шапиро М.А., Шапиро С.А. Аналитическая химия. – М.: Высшая школа, 1979.
4. Толстоумов В.Н., Эфрос С.М. Задачник по количественному анализу.- Л.: Химия,1986
5. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. – М.: Высшая школа, 1979.
6. Крешков А.П, Ярославцев А.А. Курс аналитической химии, ч 1., ч.2. Качественный анализ – М.: Химия, 1981.
7. Лурье Ю.Ю.Справочник по аналитической химии. – М.: Химия, 1979.
8. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия, т. 1,2. – М.: Химия, 1990.
9. Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1. Титриметрические и гравиметрические методы анализа:Учеб. М.: Дрофа, 2002.
10. Аналитическая химия. Аналитика: Учебник: в 2кн. / Ю.Я. Харитонов. М.: Высшая школа, 2003.
11.Скуг Д., Уэст Д. Основы аналитической химии / пер. с англ. В 2кн.. М.: Мир, 1979.
12. Основы аналитической химии. Задачи и вопросы: Учеб. пособие для сузов/ В.И. Фадеева и др. Под ред. Ю.А. Золотова. - М.: Высшая школа,2002 - 412 с.
13. Задачник по аналитической химии/ Н.Ф. Клещев, Е.А. Алферов. Н.В. Базалей и др.; Под ред. Н.Ф. Клещева. – М.: Химия, 2003. – 224 с.
14. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 2009. – 448 с.
Министерство образования Саратовской области
Государственное образовательное учреждение среднего профессионального образования
Поволжский колледж технологий и менеджмента
ЭКЗАМЕНАЦИОННЫЙ МАТЕРИАЛ
ОП.05.
«Аналитическая химия»
для специальности 240107
«Химическая технология неорганических веществ»
2010г.
| Одобрена ПЦК | Составлена в соответствии с | |
| Пр.№_____ от «____»______200_г. | ГОС СПО по специальности | |
| Председатель _________А.С.Жевелюк | ||
| Утверждаю | ||
| Зам.директора по УИДиП | ||
| ___________Ю.В.Махова | ||
Составил: преподаватель спец дисциплин.
Комарова С.В. _____________
Рецензенты:
1.________________/________________/(внешний)
2.________________/________________/
 2015-08-13
2015-08-13 10502
10502







