
2) Совместное решение графическим методом уравнений материального и теплового балансов для реакции A→R, ∆H<0. Адиабатический РИС. Тепловая устойчивость.
Химический реактор – основной аппарат любого химического процесса:
1) он определяет экономическую эффективность всего технологического процесса
2) определяет конструктивные особенности процесса
3) определяет технические показатели
4) определяет эксплуатационные характеристики.
Реакторы смешения – это емкостные аппараты с перемешиванием механической мешалкой или циркуляционным насосом.
Для идеального смешения характерно абсолютно полное выравнивание всех характеризующих реакцию параметров по объему реактора.
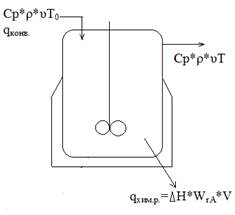
Адиабатический режим характеризуется полным отсутствием теплообмена с окружающей средой (qтеплообм=0). В этом случае вся теплота химической реакции полностью расходуется на нагрев или охлаждение реакционной смеси. для стационарного адиабатического режима: |Qвх - Qвых|=|Qхр|.
Рассмотрим простую необратимую эндотермическую реакцию: A→(K)R
1. Кинетическое уравнение: WrA=k*CA
2. Уравнение материального баланса: τср=V/υ=(CA0 – СА)/WrA
По определению степени превращения хА=(CA0 – СА)/ CA0,
тогда CA0 – СА=хА*СА0.
Тогда УМБ: τср=V/υ=CA0*хА/WrA
3. Уравнение теплового баланса в общем виде:
Qвх - Qвых± Qхр± Qто=Qнак
В стационарном режиме работы реактора: Qвх - Qвых± Qхр± Qто=0
Так как в адиабатическом реакторе Qто-0, то |Qвх - Qвых|=|Qхр|
ρ*Cp*υ(T0-T)-∆H*WrA*V=0
Решение:
1. τср= CA0*хА/WrA= CA0*хА/ k*CA
По определению степени превращения: СА=СА0(1-хА)
Тогда τср== CA0*хА/ k*CA== CA0*хА/ [k*СА0(1-хА)}
τср=xA/[K(1-xA)] → xA=1/[1+1/(K* τср)]
2.Согласно уравнению теплового баланса: ρ*Cp*υ(T0-T)-∆H*WrA*V=0
Подставим в него кинетическое уравнение: ρ*Cp*υ(T0-T)-∆H* k*CA *V=0
СА=СА0(1-хА)
Выразим степень превращения: xA=(Cp*ρ/CA0*∆H)*(T0-T)
Зависимость между степенью превращения и Т является линейной. Эта прямая линия пересекает ось температур в точке Т=Т0:
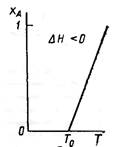
Если принять хА=1 (т.е. реакция прошла до конца), то получим
Т0 – Тх=1=∆Тад=Cp*ρ/CA0*∆H.
Величина ∆Тад – максимальное изменение температуры реакционной смеси, возможное в адиабатических условиях, или адиабатическое изменение температуры.
Тогда: xA=(1/∆Tаб.)*(T0-T) (1) – первое уравнение математической модели
второе уравнение представляет собой уравнение материального баланса:
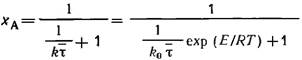 (2)
(2)
Возможно лишь графическое решение.
экзотермическая реакция - ∆Н<0
tgα>0
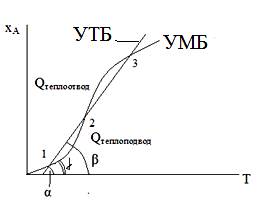
Если в адиабатическом реакторе проводят необратимую экзотермическую реакцию, система уравнений материального и теплового балансов может иметь как одно, так и несколько решений, отвечающих стационарному режиму (три решения – точки 1, 2 и 3). На практике из трех возможных решений будет реализовано одно. Желательно конечно же, чтобы работа реактора характеризовалась высокой степенью превращения исходного реагента, т.е. соответствовала точке 3.
Возможно ли это? Как при наличии нескольких стационарных состояний практически обеспечить наиболее выгодное? ответить на эти вопросы помогает анализ устойчивости стационарных состояний.
Устойчивость системы в стационарном состоянии определяется ее реакцией на возмущающее воздействие.
Стационарное состояние системы называется устойчивым, если небольшие кратковременные возмущающие воздействия не могут вывести систему за пределы небольшой области, окружающей исследуемый стационарный режим.
Преобразуем уравнения:
xA=(Cp*ρ/CA0*∆H)*(T0-T)
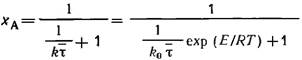
умножив их на тепловой эффект реакции ∆Н.
Уравнение теплового баланса примет вид:
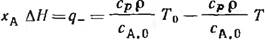
Произведение теплоемкости на плотность реакционной смеси и ее температуру, отнесенное к начальной концентрации, представляет собой физическую теплоту реакционной смеси, приходящуюся на 1 моль исходного вещества, вошедшего в реактор.
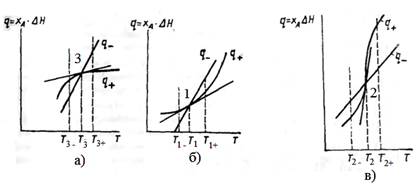
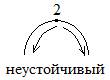
Рис. Устойчивые (а, б) и неустойчивое (в) стационарные состояния адиабатического РИС при проведении экзотермической реакции.
Рассмотрим точку 3. Пусть вследствие некоторого возмущения состояние теплового равновесия нарушится; например, в системе установится более высокая температура Т3+. В этом положении удельный теплоотвод q- превышает удельный теплоотвод q+ и после снятия возмущения произойдет самопроизвольное снижение температуры до Т3, т.е. система вернется в прежнее состояние равновесия. Если при нарушении равновесия температура в реакторе понизится до Т3-, то после снятия возмущения произойдет самопроизвольный разогрев до температуры Т3 вследствие того, что q+>q -. Таким образом, точка 3 соответствует устойчивому стационарному состоянию адиабатического реактора идеального смешения.
Анализ состояния теплового равновесия в очке 1 также позволяет сделать вывод, что это решение системы уравнений отвечает устойчивому стационарному состоянию.
Иным будет положение теплового равновесия средней точки пересечения 2. Отклонение от состояния равновесия вправо по оси температур приведет к дальнейшему самопроизвольному разогреву, влево – к самопроизвольному понижению температуры. Следовательно, равновесие системы в точке 2 является неустойчивым.
Три режима:
2 устойчивых
1 неустойчивый
Условие тепловой устойчивости:
dQтеплоотвода/dT>dQтеплоподвода/dT
1 и 3 режимы устойчивые (β>γ)
2-ой – неустойчивый
3) Физико-химические основы процесса синтеза аммиака. Выбор технологического режима (температура, давление, концентрации компонентов, объемная скорость). Способы осуществления оптимального температурного режима. Технологическая схема.
Аммиак – ключевой продукт различных азотсодержащих веществ, применяемых в промышленности и сельском хозяйстве. Аммиак используется для получения азотной кислоты, полимерных материалов, в холодильной технике, для производства минеральных удобрений.
Состав аммиака был установлен Бертолле в 1784 году. Аммиак – NH3 – основание, умеренно сильный восстановительный агент и эффективный комплексообразователь.
NH3- газ с резким запахом.
Тконд= -33,5ᵒС
Тплавл= -77,8ᵒС
Растворимость: в 1л воды растворяется 700 л NH3
С воздухом аммиак образует взрывчатую смесь в интервале (15-27%)NH3
Синтез аммиака из элементов осуществляется по уравнению реакции: N2+3H2↔2NH3+Q – обратимая, экзотермическая.
Согласно принципу Ле-Шателье при нагревании равновесие смещается влево, в строну уменьшения выхода аммиака. Реакция синтеза аммиака протекает с уменьшением объема. Значит для интенсификации процесса получения аммиака необходимо: t↓ (420-550 ᵒС) и p↑ 320 атм, катализатор Fe.
Синтез аммиака протекает с заметной скоростью только в присутствии катализатора, причем твердого катализатора (железо). Гетерогенно-каталитический процесс синтеза аммиака имеет сложный механизм:
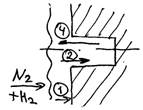
1) внешняя диффузия N2 и Н2 к поверхности катализатора;
2) Диффузия внутри пор катализатора
3) Химическая реакция на поверхности катализатора
3.1 Абсорбция на активных центрах Ϭ катализатора
N2+2Ϭ→2NϬ
H2+2Ϭ→2HϬ
3.2 Взаимодействие поверхностных комплексов:
NϬ+HϬ→NHϬ+Ϭ (NHϬ - имид)
NHϬ+ HϬ→NH2Ϭ+Ϭ (NH2Ϭ - амид)
NH2Ϭ+HϬ→NH3Ϭ+Ϭ (NH3Ϭ - аммиак)
3.3 десорбция NH3 с поверхности катализатора
NH3Ϭ→ NH3+Ϭ
4) Диффузия NH3 в порах катализатора
5) Диффузия NH3 через пограничную газовую пленку в газовый поток.
Лимитирующая стадия – хемосорбция азота (диффузия внутри пор катализатора).
Скорость обратимой реакции получения аммиака из элементов на большинстве катализаторов описывается уравнением Темкина-Пыжева:
w= dрNH3/dτ=k1*рN2*(р1,5 H2/рNH3)-k2*(рNH3/р1,5Н2)
Скорость реакции синтеза аммиака зависит от температуры, давления и состава реакционной смеси. Оптимальными считают такие значения указанных параметров, при которых скорость процесса максимальна.
Из этого уравнения видно, что скорость прямой реакции синтеза пропорционально р1,5, а скорость обратной – р0,5. Очевидно, что с ростом давления скорость процесса увеличивается.
С ростом давления увеличивается расход электроэнергии, при понижении давления снижается расход энергии, но увеличиваются размеры аппаратов. Для определения оптимального давления синтеза была использована комплексная математическая модель агрегата синтеза аммиака. В качестве критерия оптимизации – приведенные затраты.
На основании анализа определено, что наиболее эффективным является давление около 30 МПа.
Особенности:
1) высокое давление
2) наличие циркуляционного контура
3) использование холода для разделения газовой смеси
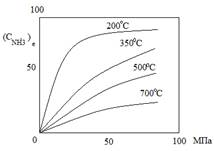
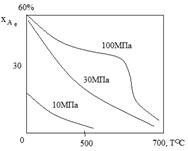
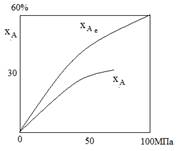
Так как присутствие инертных примесей в реакционной смеси равносильно снижению общего давления, то с увеличением содержания метана, аргона и гелия в смеси скорость реакции синтеза уменьшается.
С повышением содержания аммиака общая скорость реакции падает.
Влияние объемной скорости потока υ.
Увеличение объемной скорости смеси приводит к уменьшению прироста содержания аммиака и, тем самым к росту средней скорости и повышению производительности процесса.
υV=υ/V=1/τ [час-1]
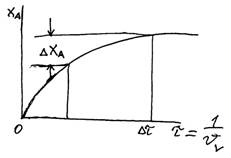
Увеличение υV в 4 раза снижает хА на 20%.
qR= υV*CR=ψAR* υV*CA0*xA
Нарушение автотермичности
Рабочие υV=30*103 1/час
хА=18%
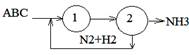
1 – синтез аммиака
2 – выделение аммиака
Реакция синтеза аммиака обратима, поэтому полного превращения азота и водорода в аммиак за время их однократного прохождения через аппарат не происходит. Для более полного использования реагентов необходима их многократная циркуляция через колонну синтеза.
Устройство колонны синтеза.
Особенности:
- надежность
- прочность (320 атм.)
- оптимальный температурный режим
- использование избыточного тепла
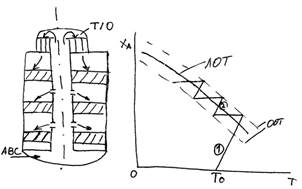
АВС – для снижения температуры
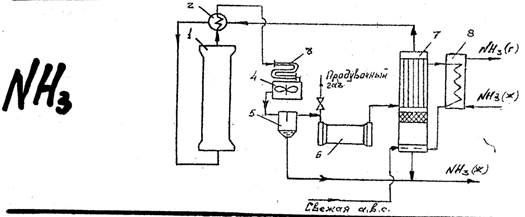
1 – колонна синтеза
Давление 30 МПа
8 – аммиачный холодильник.
Чтобы выделить аммиак, азотоводородную смесь вместе с аммиаком охлаждают до температуры сжижения аммиака. Концентрация аммиака в азотоводородной смеси, содержащей инертные газы, в состоянии насыщения при давлении 30 МПа и различных температурах:
| Т, ᵒС | -10 | |||||
| СNH3, % | 2,1 | 3,2 | 4,7 | 5,5 | 7,3 |
СNH3 – остаточное в газе (то, что остается и не конденсируется).
Поэтому целесообразно в систему подавать жидкий аммиак, который охлаждает газ до -10ᵒС
Часть газа накапливается (Ar) и поэтому от них надо избавляться. Это делается путем сбрасывания продувки. 7% нашего газа сбрасывается в трубу и сжигается.
Свежий газ (азото-водородная смесь) после очистки от посторонних примесей и после охлаждения поступает нижнюю часть конденсационной колонны 7 для очистки от остаточных примесей СО2, Н2О. Свежий газ барботирует через слой сконденсировавшегося жидкого аммиака, особождается от водяных паров и следов СО2, насыщается аммиаком и смешивается с циркуляционным газом. Полученная смесь проходит по трубкам теплообменника конденсационной колонны и нагревается в теплообменнике 2, протекая по трубам. Затем поступает в колонну синтеза 1. В колонне синтеза 1 газ проходит снизу вверх по кольцевой щели между корпусом колонны и поступает в межтрубное пространство внутреннего теплообменника, размещенного в горловине колонны синтеза. В теплообменнике циркуляционный газ нагревается до температуры начала реакции и затем проходит четыре слоя катализатора, концентрация аммиака в газе увеличивается. Пройдя через центральную трубу азотоводородно-аммиачная смесь направляется во внутренний теплообменник, где охлаждается до 300ᵒС. Дальнейшее охлаждение в теплообменнике 3, в трубном пространстве теплообменника 2 холодным циркуляционным газом. Часть аммиака конденсируется. Жидкий аммиак, сконденсировавшийся при охлаждении, отделяется в сепараторе 6, смешивается с жидким аммиаком из конденсационной колонны 8 и из нижней ее части.
Циркуляционный газ поступает в систему вторичной конденсации, поступает в колонну 8 охлаждается до 18ᵒС за счет аммиака охлажденного в аммиачной колонне 8. В сепарационной части колонны 8 происходит отделение жидкого аммиака от газа и смешение свежей АВС с циркуляционным газом.
 2015-08-13
2015-08-13 1571
1571
