Об эффективности осуществления любого промышленного процесса судят в первую очередь по экономическим показателям: прибыль, себестоимость продукции, приведенные затраты.
Для оценки эффективности отдельных этапов процесса необходимо учитывать также и такие критерии эффективности, которые более полно отражали бы химическую и физико-химическую сущность явлений, происходящих в отдельных аппаратах технологической схемы.
Общепроизводственные критерии:
- производительность – это количество продукта, полученное в единицу времени.
ПR=nR/τ [кг/ч, т/сут, т/год]
nR – количество продукта
CR=nR/V – концентрация продукта
V – объем
v=V/τ – объемный расход реакционной смеси
ПR=CR*v
- интенсивность – производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата, - его объему, площади поперечного сечения.
IR=ПR/V= nR/Vτ [кг/м3*час]
Технологические критерии эффективности.
A→R
CA0 – начальная концентрация исходного реагента А
СА – конечная концентрация исходного реагента А
|
|
|
1 ) степень превращения исходного реагента
xA=∆CA/CA0=CA0-CA/CA0 – доля прореагировавшего исходного реагента.
А+В→R
xA= CA0-CA/CA0
xВ= CВ0-CВ/CВ0
Уравнение материального баланса-система стехиометрических соотношений (ССС).
aA+bB→rR+sS
CA0-CA/a= CВ0-CВ/b=CR-CR0/r=CS-CS0/s
Если отсутствуют продукты в исходной смеси, тоCR0=0, CS0=0.
(СA0-CA)CA0/(a*CA0)=(СB0-CB)CB0/(b*CB0)
CA0*xA/a=CB0*xB/b – уравнение связи двух исходных реагентов
0≤x≤1
Для обратимых реакций предельным является состояние химического равновесия. Этому состоянию соответствует и предельно достижимая при данных условиях равновесная степень превращения:
xA=∆CAе/CA0=CA0-CAе/CA0
2) Полная или интегральная селективность – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевую и побочные).
φ=СA→R/CA0-CA – интегральная селективность
СA→R – превращение исходного реагента в целевой продукт
aA→(K1)rR
aA→(K2)sS
ψAR=r/a – нормировочный множитель
φ=СR/ψAR(CAo-CA)
ССС
CA0-CA/a= CR-CR0/r
CR0=0
CR= (CA0-CA)*r/a= ψAR(CA0-CA)
3) выход целевого продукта – отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях осуществления химической реакции.
ФR=CR/CRmax
CR – получаемое количество целевого продукта
CRmax его максимально возможное количество
Уравнения связи критериев эффективности.
Реакции без побочных продуктов.
| параметр | A→R | A→R А→S | A↔R | A↔R А↔S |
| φ= СA→R/CA0-CA | CR/ CA0*xA*ψAR | CR/ CA0*xA*ψAR | ||
| CR | CA0*xA*ψAR | CA0*xA*ψAR*φ | CA0*xA*ψAR | CA0*xA*ψAR*φ |
| CRmax | CA0*ψAR | CA0*ψAR | CA0*xAe*ψAR | CA0*xAe*ψAR |
| ФR=CR/CRmax | xA | xA*φ | xA/xAe | xA*φ/xAe |
(CA0-CA)*CA0/(a*CA0)=CR/r, CR=CA0*xA*ψAR
|
|
|
xAe – равновесная степень превращения (максимально возможная).

Конверсия оксида углерода – стадия производства технологического газа. Физико-химические основы процесса, выбор технологического режима, характеристика катализаторов, аппаратурное оформление.
Принципиальная схема получения азотоводородной смеси.
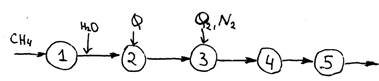
1 – очистка СН4
2 – трубчатая печь, паровая конверсия
3 – кислородная конверсия
4 – конверсия СО
5 – очистка СО и СО2
Основным источником сырья для получения синтез-газа является твердое топливо, которое перерабатывается по следующим реакциям:
С+Н2О↔СО+Н2-Q
С+О2↔СО2+Q
Синтез-газ получают по первой реакции, а необходимая температура слоя топлива достигается благодаря проведению второй реакции. Полученный водяной газ содержит 50-53% Н2 и 36% СО. Для дальнейшего использования в производстве водяной газ очищают от сернистых соединений и проводят конверсию оксида углерода по реакции:
CO+H2O↔CO2+H2+Q
Эта реакция частично осуществляется уже на стадии паровой конверсии метана, однако степень превращения оксида углерода при этом очень мала и в выходящем газе содержится до 11% СО и более. Для получения дополнительных количеств водорода и снижения до минимума концентрации СО в конвертированном газе осуществляют самостоятельную стадию каталитической конверсии СО водяным паром.
Синтез-газ - состоит из СО и Н2. Получают конверсией природного горючего газа с водным паром и О2, а также газификацией топлив. Сырье в производстве углеводородов, метилового спирта и др.
Синтез-газ из углеводородных газов является основным источником получения аммиака и метанола.
Конверсия газов - переработка газов с целью изменения состава исходной газовой смеси.
В соответствии с условиями термодинамического равновесия повысить степень конверсии СО можно удалением диоксида углерода из газовой смеси, увеличением содержания водяного пара или проведением процесса при возможно низкой температуре (∆H<0). Согласно уравнению конверсия СО протекает без изменения объема, поэтому повышение давления не вызывает смещения равновесия (∆V=0). Однако проведение процесса при повышенном давлении оказывается экономически выгодным – увеличивается скорость реакции, уменьшаются размеры аппаратов (Р=3-4 МПа).
Проведение процесса при низких температурах – рациональный путь повышения равновесной степени превращения оксида углерода, но возможный только при наличии высокоактивных катализаторов.
Отметим, что нижние предельные температуры процесса ограничены условиями конденсации водяного пара. Снижение температуры ниже точки росы (температура, до которой должен охладиться воздух, чтобы содержащийся в нём водяной пар достиг состояния насыщения и начал конденсироваться в росу) вызывает конденсацию влаги на катализаторе, что нежелательно.
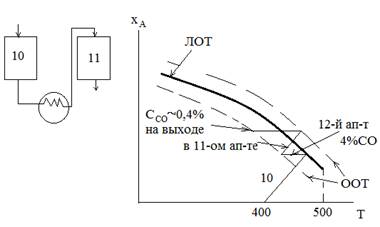
Реакция конверсии СО сопровождается выделением большого количества теплоты, что обусловило проведение процесса в две стадии при разных температурных режимах на каждой. На первой стадии высокой температурой (Т=470ᵒС) обеспечивается высокая скорость конверсии большого количества оксида углерода; на второй стадии при пониженной температуре (Т=220ᵒС) достигается высокая степень конверсии оставшегося СО. Теплота экзотермической реакции используется для получения пара.
Температурный режим на каждой стадии конверсии определяется свойствами применяемых катализаторов. На первой стадии используется железохромовый катализатор FeCr. Для него ядами являются сернистые соединения. Органические сернистые соединения в присутствии железохромового катализатора взаимодействуют с водяным паром с образованием сероводорода.
Низкотемпературные катализаторы содержат соединения меди, цинка, алюминия, иногда хрома. В качестве добавок к указанным компонентам применяются соединения магния, титана, палладия, марганца, кобальта. Наличие в низкотемпературных катализаторах соединений алюминия, магния, марганца сильно повышает их стабильность, делает более устойчивыми к повышению температуры.
|
|
|
Срок службы низкотемпературных катализаторов обычно не превышает двух лет. Одна из причин их дезактивации – рекристаллизация под действием температуры и реакционной среды. При конденсации влаги на катализаторе происходит снижение его механической прочности и активности.
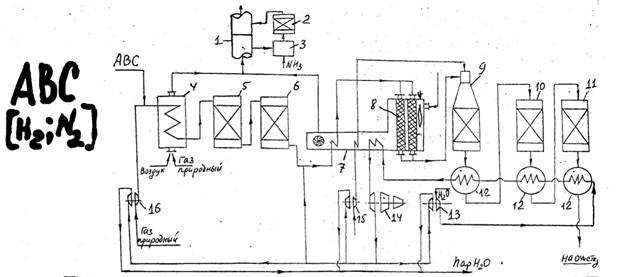
Природный газ сжимают в компрессоре 16, смешивают с азотоводородной смесью и подают в подогреватель 4, где реакционная смесь нагревается до 370-400ᵒС. Далее нагретый газ подвергают очистке от сернистых соединений: в реаторе 5, а затем в адсорбере 6 сероводород поглощается сорбентом. Очищенный газ смешивается с водяным паром и полученная парогазовая смесь поступает в конвекционную зону трубчатой печи 8. В радиационной камере печи размещены реакционные трубы, заполненные катализатором конверсии метана, и горелки, в которых сжигается природный или горючий газ. Парогазовая смесь нагревается в подогревателе 7 и затем под давлением распределяется сверху вниз по большому числу труб, заполненных катализатором. В трубчатой печи 8 выделяется большое количество тепла, и это тепло расходуется на подогрев в реакторе 9, где происходит паровоздушная конверсия. Температура на выходе 800-900ᵒС. При этой температуре газ направляется в котел-утилизатор12, вырабатывающий пар. Здесь реакционная смесь охлаждается до 500ᵒС и идет в конвертор СО I ступени10, где на железохромовом катализаторе протекает конверсия основного количества оксида углерода водяным паром. Выходящая из реактора газовая смесь поступает в паровой котел 12, где охлаждается до 220ᵒС и подается в конвертор СО II ступени 11, заполненный низкотемпературным катализатором, где содержание СО снижается до 0,5%. Ковертированный газ на выходе из конвертора 11 имеет следующий состав:
|
|
|
Н2-61,7 % СО – 0,5 СО2 – 17,4 N2+Ar – 20,1 CH4 – 0,3
После охлаждения конвертированный газ при температуре окр. среды поступает на очистку.
Из 13 насоса вода поступает в 12 холодильник, вода испаряется, получаем пар низкого давления. Затем пар идет в следующий 12 холодильник (400-500ᵒС). Получаем пар среднего давления и затем в последний 12 холодильник, получаем пар высокого давления. Пар поступает в трубчатую печь 7, перегревается и идет на 14 турбину. На ней вырабатывается электроэнергия. Пар теряет свои свойства и становится паром среднего давления. Идет в 15 и 16 турбины и приводит в действие насосы.
Таким образом, конверсия СО происходит в 10 и 11 реакторах.
1) применяется оптимальный температурный режим, который осуществляется в двух реакторах.
 2015-08-13
2015-08-13 3656
3656
