Гетерогенные процессы – процессы, в которых участвуют вещества в различных фазах. Между фазами существует граница раздела фаз.
Глубина протекания гетерогенных процессов оценивается по изменению твердого вещества.
Два варианта:
1) размеры твердой частицы уменьшаются;
2) размеры остаются постоянными.
Для описания гетерогенных процессов разработан ряд кинетических моделей. Наиболее распространены 2 модели:
1) модель квазигомогенная ( гетерогенный процесс протекает одновременно в любой точке объема твердой частицы ).
2 ) модель с фронтальным перемещением зоны реакции (модель с невзаимодействующим ядром).
Допущения:
- реакция начинается на внешней поверхности частицы и после ее завершения в реакцию вступают глубинные слои;
- с течением времени зона реакции продвигается вглубь частицы;
- за зоной реакции остается твердый продукт.
В произвольный момент времени твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой. Ядро состоит из непрореагировавшего реагента, поэтому эту модель называют моделью с непрореагировавшим ядром.
На примере гетерогенной реакции:
aA+bB→rR+sS
газ+тв в-во→газ+ тв в-во
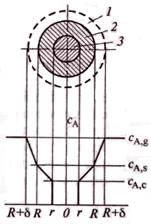
Профиль изменения концентрации газообразного реагента при взаимодействии с твердой частицей.
1-пограничная газовая пленка с концентрацией реагента А ниже, чем в газовом потоке; 2-слой твердых продуктов реакции (слой золы); 3-ядро непрореагировавшего реагента В.
Рассмотрим стадии гетерогенного процесса, которые описываются моделью с фронтальным перемещением зоны реакции.
I) внешняя диффузия – подвод реагента А к пов-ти твердой частицы через слой газа, обедненный этим компонентом.
Происходит в пограничном слое.
В результате протекания реакции aA+bB→продукты
концентрация газообразного реагента А у пов-ти твердой частицы ниже, чем в ядре газового потока. Пусть δ – толщина поверхностной газовой пленки. За ее пределами концентрация газообразного реагента постоянна и равна СA,g, а внутри пленки СА уменьшается от СA,g до концентрации на поверхности твердой частицы СA,s.
Вещество А переносится из ядра газового потока к пов-ти частицы за счет молекулярной диффузии (в результате хаотического движения молекул, не связанного с движением потоков жидкости) и вследствие конвективного переноса (движения с газовой средой в направлении, совпадающем с направлением потока).
Уравнение Щукарева:
wlA= -(1/F)*(dnA/dτ)=β(CAg-CAs) – скорость конвективной диффузии, т.е количество газообразного А перенесенного вследствие конвективной диффузии через единицу пов-ти в единицу времени.
β – коэффициент массоотдачи, зависящий от гидродинамики потока, β=D/δ1
D – коэф-т молекулярной диффузии
δ1-диффузионный подслой
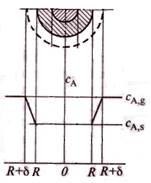
Повысить скорость внешней диффузии можно, увеличивая движущую силу, которая равна CAg-CAs, либо коэффициент массоотдачи.
II) внутренняя диффузия – проникновение газообразного реагента через поры твердого продукта реакции к поверхности ядра, на которой осуществляется химическое взаимодействие.
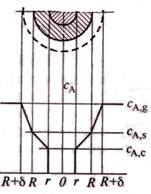
Закон Фика выражает скорость внутренней диффузии:
wdA= -(1/F)*(dnA/dτ)=Dэф*(dCA/dr)
Dэф – эффективный коэф-т диффузии, учитывающий пористость твердого вещества.
Так как слой твердых продуктов реакции представляет собой определенное сопротивление переносу реагента А из пограничной газовой пленки к пов-ти ядра, то концентрация этого реагента по мере движения к поверхности ядра будет уменьшаться от СA,s на внешней поверхности твердой частицы до СА,с на поверхности ядра.
Если толщина слоя золы невелика, то:
dCA/dr=∆CA/∆r=(CA,s – CA,c)/(R-r)
Тогда скорость внутренней диффузии:
wdA= (Dэф/∆r)*(CA,s-CA,c)=β’(CA,s-CA,c)
β’=Dэф/∆r
Измельчение твердых частиц продукта – основной путь интенсификации внутренней диффузии.
III) Химическая реакция на поверхности ядра
wrA=kS*CnA,с
kS – константа скорости поверхностной химической реакции.
Если химическая реакция необратима, концентрация газообразного реагента на пов-ти ядра уменьшится от CA,c, достигнутой после стадии внутренней диффузии, до нуля (до полного расходования).
Скорость химической стадии может быть увеличена либо вследствие возрастания концентрации газообразного реагента CA,c, либо вследствие роста константы скорости kS.
Основной путь интенсификации гетерогенного процесса, протекающего в кинетической области, - повышение температуры.
wrA<<wdA – кинетическая область
wdA<<wrA - диффузионная область
Возможны ситуации, когда сопротивление одной из стадий существенно превышает сопротивление других стадий. Такая стадия называется лимитирующей.
Особенности лимитирующей стадии.
1) обладает максимальным сопротивлением и минимальным коэффициентом интенсивности;
2) скорость всего процесса равна скорости лимитирующей стадии;
3) лимитирующая стадия имеет максимальное изменение концентрации реагента.
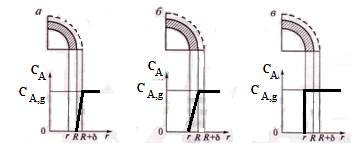
Профиль изменения концентрации газообразного реагента при лимитировании гетерогенного процесса внешней (а), внутренней (б), диффузиями и химической реакцией (в).
 2015-08-13
2015-08-13 2202
2202
