Химический реактор – основной аппарат любого химического процесса:
1) он определяет экономическую эффективность всего технологического процесса
2) определяет конструктивные особенности процесса
3) определяет технические показатели
4) определяет эксплуатационные характеристики.
Реакторы смешения – это емкостные аппараты с перемешиванием механической мешалкой или циркуляционным насосом.
Для идеального смешения характерно абсолютно полное выравнивание всех характеризующих реакцию параметров по объему реактора.
Какие задачи решает теория химических реакторов?
1) разработка методов расчета реакторов
2) разработка принципов математического моделирования
3) оптимизация различных типов реакторов.
На конструкцию реактора влияет:
- фазовое состояние системы
- тепловые условия
- кинетические особенности
- уровень давления
- характер воздействия реакционной среды на материал аппарата (коррозионные особенности).
Требования к реакторам:
1) обеспечение оптимального времени пребывания
2) создание наилучшего контакта реагирующих веществ
3) обеспечение оптимальной температуры
4) механическая и коррозионная стойкость
5) удобство обслуживания, монтажа и ремонта, малый вес, малая стоимость.
Вводится понятие идеальных потоков.
1) они характеризуются ясностью физической картины
2) простота математического описания
3) удобство анализа протекания процесса
Идеальные потоки:
1) поток идеального вытеснения
2) поток идеального смешения
- равномерность перемешивания
- постоянство полей Ci, Т, Р
С=const
T=const
Особенности идеальных потоков.
1) они не содержат параметров, отражающих структуру потока
2) единственный параметр потока – время пребывания
Таким образом все потоки идеального смешения подобны и все потоки идеального вытеснения подобны.
КРИС - это последовательно соединенные проточные реакторы идеального смешения. Реакционная смесь проходит через все секции.
В качестве примера КРИС можно рассматривать и проточный реактор, разделенный внутри на секции, в каждой из которых осуществляется перемешивание реакционной смеси.
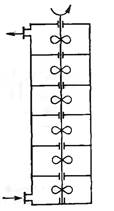
Допущения:
- каждая секция каскада представляет отдельный реактор идеального смешения (мгновенное изменение параметров процесса, равенство параметров во всех точках секции и в потоке, выходящем из нее);
- концентрация реагентов на выходе из предыдущего реактора равна концентрации на входе в следующий реактор;
- каждый последующий реактор не влияет на предыдущий.
Математическая модель – система уравнений.
1) уравнение кинетики WrAi=f(CAi)
i-1,2,3,…, n
2) уравнение материального баланса
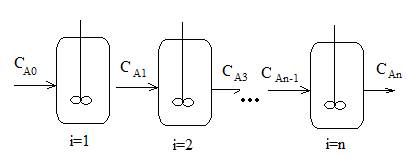
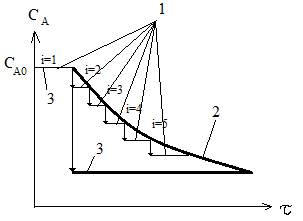
Рис. Изменение концентрации реагента при прохождении реакционной смеси через последовательные секции каскада реакторов идеального смешения (1) и реактора идеального вытеснения (2), единичного РИС (3).
Достоинства:
- малый объем как у РИВ
- простота конструкции, удобство эксплуатации и монтажа
Уравнения материального баланса для любой секции каскада однотипны. Материальный баланс по компоненту J для i-й секции в стационарном режиме работы каскада:
υ*Cj, i-1 – υ*Cj, I – wrj(Cj, i)Vi=0 или
τi ср=Vi/υ=(Cj, i-1 – Cj, i)/ wrj(Cj, i)
Решение математической модели:
1) аналитический способ. Данный метод может быть применен, если уравнения материального баланса могут быть аналитически решены относительно концентрации Cj.
Рассмотрим определение концентрации реагента А на выходе из каскада реакторов, включающего в себя n секций равного объема при проведении реакции:
A→(k) R
τ1ср=τ2ср=…=τnср
То есть объемы реакторов равны Vi=const
τ∑ср= τ1ср+ τ2ср+…+ τnср=∑ τi
i=1
Кинетическое уравнение:
WrA1= k*CA1
УМБ РИС для первой секции:
τ1 ср=V1/υ=(CА,0– CА,1)/ wrА,1
WrA1=(CA0-CA1)/τср=k*CA (1)
Выражаем из равенства (1) CA1:
CA1=CA0/(1+k*τср)
УМБ РИС для второй секции:
τ2 ср=V2/υ=(CА,1– CА,2)/ wrА,2
Кинетическое уравнение:
WrA2= k*CA2
Выражаем из равенства (1) CA2:
CA2=CA1/(1+k*τср)=CA0/(1+k*τср)2
Продолжая аналогичные расчеты, для n-й (последней) секции каскада получим:
CAn=CA0/(1+k*τср)n
Тогда число секций:
n=[ln CA0/CAn] / ln(1+k*τср)
или если учесть, что СА/СА,0=1-хА, то 1-хА=1/(1+ k*τср)n
n=lg (1/1-xA)/lg(1+ k*τср)
2) Графический метод.
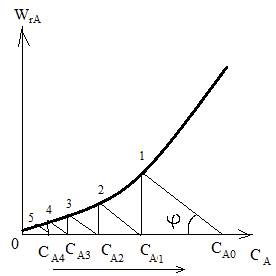
tgφ= -1/τср
1) кинетическое уравнение
WrA=f(CA)=y1
2) уравнение материального баланса
WrA=f(CA)=y2
W=1/τср *(CA0-CA1)
Сначала, графически решая уравнение для первой секции:
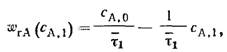
находим концентрацию СА,1, построив кинетическую кривую wrA(CA) и прямую с тангенсом угла наклона (-1/ τср i), пересекающую ось абсцисс в точке СА,0. Далее решаем уравнение для второй секции:
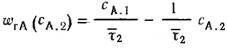
Для расчета концентрации на выходе из n-го реактора графическое решение повторяют n раз.
Если требуется рассчитать число секций n, необходимое для достижения заданной степени превращения хА, графическое построение продолжают до тех пор, пока абсцисса точки пересечения прямой
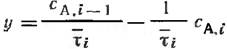
и кривой wr, A(CA) не будет удовлетворять условию СА1≤СА0(1-хА)
τ∑=∑τi=∑(CA i-1 – CA1)/WrAi
При n→∞ τ∑=lim ∑∆CAi/WrAi= -∫ (от CА0 до САк) dCA/WrA=τРИВ
3) Абсорбция нитрозных газов в производстве слабой азотной кислоты. Выбор технологического режима и аппаратурное оформление процесса.
Процесс производства разбавленной азотной кислоты включает три стадии:
- конверсия аммиака с целью получения оксида азота
4NH3+5O2→4NO+6H2O
- окисление оксида азота до диоксида азота
2NO+O2↔2NO2
- абсорбция оксидов азота
3NO2+H2O↔2HNO3+NO+Q
Нитрозные газы образуются при окислении аммиака:
Основная реакция: 1) 4NH3+5O2→4NO+6H2O+Q (∆Н<0, ∆V>0)
Побочные: 2) 4NH3+4O2→2N2O+6H2O
N2O – закись азота, веселящий газ.
3) 4NH3+3O2→2N2+6H2O
4) 2NH3→N2+3H2
5) 2NH3+3NO→2,5N2+3H2O
Нитрозные газы, поступающие на абсорбцию, содержат NO2, N2O4, NO, N2O, N2, N2O3.
Абсорбция – поглощение газа жидким поглотителем, в котором газ растворим в той или иной степени.
Все оксиды азота, кроме NO, взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота водой связано с растворением в ней NO2, N2O4, N2O3 и образованием азотной и азотистой кислот. Азотистая кислота является малоустойчивым соединением и распадается на азотную кислоту, оксид азота (II) и воду. Абсорбция протекает по схеме:
У нас имеется окись азота NO2.
 1 2NO2+H2O↔HNO3+HNO2+Q
1 2NO2+H2O↔HNO3+HNO2+Q
HNO2 – азотистая кислота, неустойчивая, разлагается.
 2 3HNO2→2NO+HNO3+Q
2 3HNO2→2NO+HNO3+Q
Суммарно взаимодействие NO2 с водой можно представить уравнением:
3NO2+H2O↔2HNO3+NO+Q (∆H<0, Т↓, Т=50-60ᵒС, Р↑, Р=3,7 атм.)
NO в межтарельчатом пространстве окисляется до NO2.
 3 2NO+O2↔2NO2+Q
3 2NO+O2↔2NO2+Q
Снова образуется NO2 , контактирует с водой и все повторяется.
Стадии:
1) диффузия к поверхности жидкости. В пограничном слое газ-жидкость диоксид азота переходит в жидкую фазу.
2) Затем после растворения NO2 происходит быстрая химическая реакция (реакция № 1)
3) в жидкой фазе происходит медленная реакция (реакция № 2)
Образующееся NO плохо растворяется в воде.
4) выделение из жидкости NO
5) окисление NO (реакция № 3) в газовом потоке.
Одновременно с абсорбцией и протеканием химических реакции в растворе в газовой фазе частично происходят те же реакции, приводящие к образованию азотной кислоты. Медленным процессом, определяющим скорость поглощения оксидов азота, является диффузия их в жидкую фазу.
Этот процесс повторяется на 48 –ми тарелках. На выходе получается 57% HNO3.
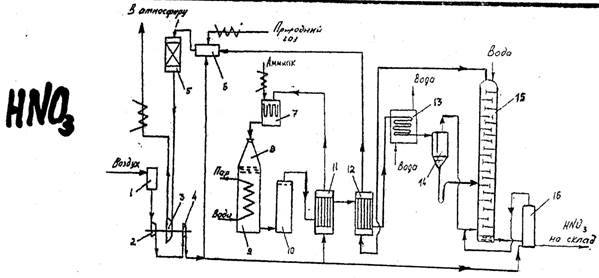
В сепараторе 14 нитрозные газы отделяют от сконденсировавшейся азотной кислоты, из него азотную кислоту направляют в абсорбционную колонну 15, а нитрозные газы – под нижнюю тарелку абсорбционной колонны. Сверху в колонну подают воду. Образующаяся в верхней части колонны азотная кислота низкой концентрации перетекает на нижележащие тарелки. Вследствие поглощения оксидов азота концентрация кислоты постепенно увеличивается и на выходе достигает 55-58%, причем содержание растворенных в ней оксидов азота достигает 1%. Поэтому кислота направляется в продувочную колонну 16, где подогретым воздухом из нее отдувают оксиды азота, и чистая кислота идет на склад. Воздух после продувки подается в нижнюю часть абсорбционной колонны 9.
Степень поглощения диоксида азота водными растворами азотной кислоты определяется температурой, давлением, концентрацией кислоты. С понижением температуры и концентрации кислоты и повышением давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение практически прекращается.
В промышленности используют абсорбционные колонны с колпачковыми и ситчатыми тарелками.
 2015-08-13
2015-08-13 4937
4937








