Скорость химической реакции это количество реагента или продукта, которое исчезает или появляется вновь в единице объема за единицу времени. Она зависит: 1) от реакционной способности химических веществ, 2) концентрации, температуры и др., 3) подвижности компонентов, степени их перемешивания, 4) наличия катализатора.
W= -dCA/dτ
wrA=kCACB=kCA(CB0-CA0+CA)
Принципы химической кинетики.
Скорость химической реакции пропорциональна концентрациям исходных реагентов.
aA+bB→rR
W≈CaA * CbB
2) Принцип независимости протекания элементарных реакций;
3) Скорость реакции по одному из компонентов равна алгебраической сумме скоростей реакции, в которой участвует этот компонент.
Функциональная зависимость скорости химической реакции от концентраций компонентов реакционной смеси называется кинетическим уравнением.
Элементарная реакция – реакция, осуществление которой связано с преодолением одного энергетического барьера.
Механизм этой реакции соответствует закону действующих масс.
aA+bB→rR
W≈CaA * CbB
Порядок реакции: частный порядок реакции – это показатель степени, с которой концентрации входят в кинетическое уравнение. Общий порядок – равен сумме показателей степеней всех реагентов, которые входят в кинетическое уравнение.
Порядок реакции является эмпирической величиной и получается из кинетического уравнения.
aA+bB→rR
nA=a, nB=b
nобщ=∑ni
nобщ=a+b – общий порядок реакции
Элементарные реакции проходят через один энергетический барьер. У них кинетическое уравнение и порядок совпадают.
2NO+Br2↔2NOBr
nNO=2
nBr2=1
nобщ=2+1=3
Неэлементарная реакция:
2H2O2→2H2O+O2
nH2O2=1
Правило составления кинетического уравнения.
1) для исходных реагентов знаку «+»
2) для продуктов реакции знаку «-»
Сложные реакции:
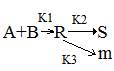
WrR= -K1*CA*CB+K2*CR+K3*CR
Неэлементарные реакции:
aA+bB→(K1)rR
WrA=K1*CαA*CβB
α≠a
β≠b
α и β – частные порядки реакции – находят экспериментально
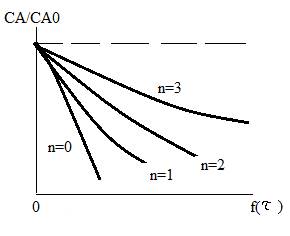
Влияние порядка реакции.
aA→(K)rR
(1/n-1)*[(1/CA)n-1 – (1/CA0)n-1]=kτ
Согласно закону действующих масс, число элементарных актов превращения будет пропорционально числу встреч частиц А и В.
W≈KCaA*CbB - элементарная реакция
W≈KCαA*CβB - неэлементарная реакция
Из кинетического уравнения следует, что скорость простой реакции пропорциональна концентрациям веществ, являющихся реагентами в данной реакции. Значит, для простых реакций увеличение концентрации исходных веществ практически всегда приводит к увеличению скорости (за исключением реакции нулевого порядка, скорость которых не зависит от концентрации).
Если реакция, описываемая уравнением aA+bB→rR+sS, характеризуется различающимися частными порядками по компонентам А и В, наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок.
Например, W≈KC2A*C0,25B
Увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а повышение В в 2 раза – лишь в 1,19 раз.
Влияние давления.
Влияние давления зависит от типа химической реакции.
WrA=f(Pn-1)
Если n=1, то от давления не зависит
n=2, то прямая зависимость
Как происходит реакция:
1) столкновение исходных молекул, соударение
2) не любое столкновение приводит к химической реакции
3) столкновение должно иметь достаточную энергию.
При увеличении температуры на 10 градусов скорость реакции возрастает в 2-4 раза.
Распределение Больцмана – доля молекул с энергией >Еа
exp(-Ea/RT)
Более строго зависимость скорости от температуры выражается уравнением Аррениуса: WrA≈Zexp(-Ea/RT)
Z-частота столкновений.
Энергия активации Еа – величина энергетического барьера для осуществления реакции (минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие).
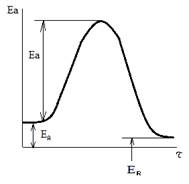
ЕА – средняя энергия компонента А.
Выводы:
lnK=lnK0-(Ea/R)*1/T
В силу неравномерности распределения температуры вдоль оси абсцисс химическая реакция более чувствительна к изменению температуры в области низких температур.
1) при различных значениях энергии активации
При изменении температуры от Т1=500К до Т2=600К скорость первой реакции
Е1=165кДж/кмоль Wr↑ в 820 раза, а второй
Е2=40кДж/кмоль Wr↑ в 5 раз
2) при постоянной энергии активации
Е1,2=165 кДж/кмоль
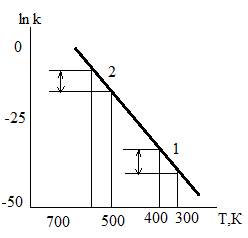
На прямой, соответствующей химической реакции с энергией активации 165 кДж/кмоль, выбраны два участка с разностью температур по 100К на в разных температурных интервалах: 1 участок-в области температур, близких к комнатной, 2 – в области более высоких температур (600К). Для участка 1 константа скорости за 100К увеличится в 1,9*107 раз, а для 2 участка за те же 100К константа увеличилась лишь в 820 раз.
Управление сложными реакциями.
Сложные реакции – обратимы.
A↔(k1)R
xA=xAe(1-exp(-k1τ/xAe))
3) Химико-технологическая схема получения слабой азотной кислоты. Стадия абсорбции оксидов азота, её физико-химические особенности и аппаратурное оформление.
Азотная кислота – один из важнейших многотоннажных продуктов химической промышленности. Она занимает второе место по объему производства после серной кислоты. Азотная кислота широко применяется для производства многих продуктов, используемых в промышленности и сельском хозяйстве (азотные удобрения, синтетические красители, взрывчатые вещества, нитролаки, лекарственные синтетические вещества).
Ткип=86ᵒС
Тзамерз= -41ᵒС
ρ=1,51 г/см3
Ср=0,45 кал/(г*ᵒС)
В промышленности выпускается:
1) неконцентрированная азотная кислота
СHNO3=57%
2) концентрированная азотная кислота
СHNO3=98,9%
3) реактивная – химически чистая для анализа.
Рассмотрим получение разбавленной неконцентрированной азотной кислоты.
Химическая схема получения неконцентрированной азотной кислоты.
1. 4NH3+5O2→4NO+6H2O+Q – конверсия аммиака с целью получения оксида азота
2. 2NO+O2↔2NO2+Q – окисление оксида азота до диоксида азота
3. 4NO2+О2+2H2O→4HNO3 – абсорбция оксидов азота водой
Суммарная реакция образования азотной кислоты:
NH3+2О2→ HNO3+ H2O
Азотную кислоту получают при давлении 1атм. и 7 атм.
Преимущество схемы с высоким давлением (7 атм.):
1) уменьшение габаритов аппаратов;
2) возможность создания установок с большой единичной мощностью;
3) более полное использование энергии
4) отходящие газы из абсорбционной колонны содержат 0,15% окислов азота, что упрощает их очистку;
5) простота обслуживания, снижение капитальных затрат.
Недостатки:
1) повышенный расход катализатора (платины);
2) высокие требования к чистоте газа.
I. Окисление NH3.
Основная реакция: 1) 4NH3+5O2→4NO+6H2O+Q
Побочные: 2) 4NH3+4O2→2N2O+6H2O
N2O – закись азота, веселящий газ.
3) 4NH3+3O2→2N2+6H2O
4) 2NH3→N2+3H2
5) 2NH3+3NO→2,5N2+3H2O
Побочные реакции нежелательны. Чтобы их исключить, надо вести процесс при оптимальном режиме.
Оптимальные параметры: Т=900ᵒС, τ=10-4 сек, α=1,8
α=υO2/υO2стех
υ – расход
Катализаторы:
| Pt | Pd (палладий) | Ra (радий) | |
| Сплав № 5 | 92,5 | 3,5% | |
| ГИАП 1 | 92,5 | - | 7,5% |
Проволока: диаметром 0,06-0,09 мм
1024 отв. сетка на 1см2
Таким образом:
- высокая скорость
- сетка
Любое наличие твердых частиц разрушает сетку.
Недостатки:
1) повышенный расход катализатора при 7 атм. Он служит 90 дней. Затем его заменяют.
2) высокие требования к чистоте – отсутствие механических примесей.
Для экономии платины применяют двухстадийное контактирование.
1) платиновая сетка
2) неплатиновый катализатор
(КН-2Т) Fe2O3, CrO, Co.
Это поможет сэкономить платину и снизить расход.
Принципиальная технологическая схема.
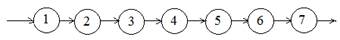
1 – очистка воздуха от механических примесей (в 1-ом аппарате).
2 – окисление NH3 (в 8 аппарате)
3 – охлаждение NO (в 9 аппарате; кател-утилизатор, охлаждает до 270ᵒС)
4 – окисление NO (10 аппарат)
5 – охлаждение смеси (11, 12, 13 аппараты).
В 13 ап-те - производится охлаждение водой до 50ᵒС, происходит конденсация образовавшейся HNO3 и она выделяется в 14 сепараторе.
6 – абсорбция NO2 (15 ап-т)
7 – очистка нитрозных газов (5 и 6 ап-ты).
 2015-08-13
2015-08-13 1977
1977
