Химическая связь - электростатическое взаимодействие двух атомов, осуществляемое путем обмена электронами. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспар.электроны связываются в общую пару – поделенная пара. При сближении атомов валентные электроны одного атома начинают притягиваться к ядрам другого атома и, наоборот, валентные электроны второго атома притягиваются к ядрам первого. Главный результат образования химической связи – уменьшение общей энергии системы ядер и электронов, а достигается этот результат путем совместного использования электронов разными ядрами. Электрон. плотность между атомами, образующими хим. связь, увеличивается. При образовании хим. связи атом стремится завершить внешний уровень и приобрести электрон. конфигурацию инертного газа, отдавая или принимая электроны. основные черты химической связи: -снижение общей энергии системы по сравнению с суммарной энергией изолированных частиц, из которых это система состоит; -перераспределение электронной плотности в области химической связи.
В зависимости от того, как происходит обмен электронами, различают следующие виды химической связи: - ионная: является полярной(Образуется в результате передачи электронов атомам одного элемента атомам другого); - ковалентная: неполярная, полярная.(Ковал. св. возникает в рез-те образования общих электронных пар);- металлич. связь: обусловлена наличием в кристаллической структуре металлов 3-х мерного каркаса, погруженного в электронный газ; - водород. связь: возникает в случае, когда атом водорода связан с очень электроотрицат.атомом другого элемента;- межмолекулярная связь: осуществляется силами Ван-дер-Ваальса или силами межмолекулярного притяжения молекул.
Природа межмолекулярной связи состоит в электростатическом взаимодействии, причём сдвиг электронов взаимодействующих молекул осуществляется внутри молекул. Силы Ван-дер-Ваальса возникают в результате действия 3-х различных факторов: 1) ориентационное взаимодействие (взаимодействие типа диполь-диполь);2) индукционное взаимодействие (диполь - индуцированный диполь);3) дисперсионное взаимодействие (взаимодействие типа мгновенный диполь – мгновенный диполь).
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электрон. пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору). Классич. пример неполярной ковален. связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотриц. атому, что делает такую связь полярной. Кроме поляризуемости ковал. связь обладает св-вом насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атом. орбиталей. О третьем свойстве ковалентной связи – направленности – речь пойдет ниже.!!!
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положит. и отриц.ательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллич. решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул.
Металлическая свя зь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицат. атому атом водорода, обладающий эффективным положит. зарядом, может взаимодействовать с другим электроотриц. атомом (F, O, N, реже Cl, Br, S). Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла. Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей. Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсал.вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Хим. связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.Темп-ры плавления ион.кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотриц-тями (нап-р, галогениды щелочных металлов). Ион. кристаллы, содержащие многоатом.ные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C. В ковалентных кристаллах решетка построена из атомов, соед-х ковал- связью, поэтому эти кристаллы обладают высокими твердостью, темп-рой плавления и низкими тепло- и электропроводностью.Кристаллич. решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положит. ионы металлов, в межузлиях – валент. электроны (электронный газ).Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Энергия связи – миним. эн., необходимая для разрушения связи.Измеряется в электронвольтах (эВ) для одной связи или в кДж/моль для одного моля связей. Эн. связи является характеристикой прочности связи – чем выше энергия связи, тем прочнее связь. Длина связи - расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) или в ангстремах (А). Чем короче связь, тем она, как правило, прочнее. Насыщаемость связи – если атом образует конечное число связей с другими атомами (обычно не более 8) – связь насыщаема, если бесконечно большое (больше 1000) – ненасыщаема. Направленность – обуславливает пространственную структуру молекул, т.е. их геометрию (форму). Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Вследствие насыщаемости связей молекулы имеют определенный состав: H2, CH4, H2S, HCl. Полярность связи характеризует степень смещения общей электронной пары к одному из атомов. Ковалентную связь, образованную одинаковыми атомами называют неполярной, а связь образованную разными атомами – полярной. Валентный угол (угол между связями) – угол между линиями, соединяющими химически связанные атомы. Валентные углы в разных молекулах могут изменяться от 600 до 1800. Кратность (порядок) связи – число электронных пар, участвующих в образовании связи. Для обычных ковалентных связей это число может быть равно 1,2 или 3.
Комплексные соединения. Основ.понят. химии комплесн.соед.: централ.атом, его координац.число, лиганды, дентатнтность, донор.атом, внутр.и внеш. координац-е сферы. Номенклатура и изомерия комплесн.соед.
Наиболее удачно свойства и строение комплексных соединений объясняет координационная теория, предложенная в 1883 г. А. Вернером. Согласно Вернеру в этих соединениях различают внутреннюю и внешнюю координационные сферы. Частица, образующая внутреннюю сферу, мало диссоциирует в растворе, и составляющие ее атомы связаны между собой ковалентными связями. Такую частицу часто называют комплексной. По характеру электрического заряда различают катионные – [Zn(NH3)4]2+, анионные – [Al(OH)6]3− и нейтральные – [Pt(NH3)2Cl2] комплексы. Комплексный ион как структурная единица входит в состав кристаллической решетки. Частицы, образующие внешнюю сферу, напротив, в растворе полностью диссоциируют.
Комплексный ион (внутренняя координационная сфера) состоит из положительно заряженного центрального атома (комплексообразователь), вокруг которого в непосредственной близости расположено или, как говорят, координировано некоторое число противоположено заряженных ионов или электронейтральных молекул, называемых лигандами (или аддендами). Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу [8]. К центральному атому лиганды присоединяются σ-, π- и δ-связями и многоцентровыми связями. Число лигандов, координируемых центральным атомом в данном соединении называется координационным числом (КЧ). А число атомов лиганда, образующих координационные связи, т.е. число мест, которое занимает лиганд в координационной сфере называется дентантностью (координационной емкостью) этого лиганда.
Если связь ядро-лиганд двуцентровые, то КЧ равно числу σ-связей, образуемых центральной частицей, т.е. числу непосредственно соседствующих с ней донорных атомов. Если связь ядро-лиганд многоцентровое, как в дибензолхроме Cr(C6H6)2, то определить дентантность становится невозможно.
Монодентантные лиганды используют в качестве донорного только один атом и занимают только одно координационное место (FЇ, СlЇ, BrЇ, IЇ, SCNЇ, CNЇ, CO, H2O, NH3 и др.). примерами полидентантных лигандов могут служить оксалат-ион ЇООС−СООЇ, этилендиамин (En) H2NCH2CH2NH2, анион этилендиаминтетрауксусной кислоты (ЭДТА4−) (Рис. 1.1). Некоторые бидентантные лиганды при присоединении к центральному атому образуют циклы, называемые хелатными. Например, в реакции гидроксида меди (II) с аминоуксусной кислотой образуется нейтральный комплекс – глицинат меди (Рис.1.2).
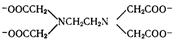 | 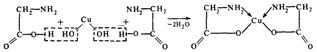 |
| Рис. 1.1 Анион ЭДТА. | Рис. 1.2 Образование хелатного комплекса глицината меди |
 2015-08-12
2015-08-12 921
921








