Существуя в трёхмерном пространстве, электрон имеет 3 степени свободы. Решая уравнение Шрёдингера современная квантовая химия определяет 3 квантовых числа, характеризующие состояние электрона в атоме, которые изменяются целочисленно, т.е. квантуются. (Квант − наименьшая, неделимая порция энергии). Их значения указывают местонахождение электрона в атоме − его наиболее вероятный «адрес». 3 квантовых числа вычислены для атома водорода при решении уравнения Шрёдингера.
1)Главное квантовое число n характеризует энергетический уровень, или общий запас энергии электрона, а также размеры электронного облака. Для реально существующих атомов n может иметь значения целых чисел от 1 до 7, соответственно номеру периода, в котором находится элемент,
| n | |||||||
| K | L | M | N | O | P | Q |
соответствующие энергетические уровни (электрон. слои) обозначаются большими буквами латин. алфавита.С увеличением n возрастают энергия электрона и размер электрон. облака.
2)Орбитальное или побочное квантовое число ℓхарактеризует энергетический подуровень и форму электронного облака.В пределах уровня электроны распределяются по подуровням.Значения ℓ связаны со значением n и принимают число значений, равное n.ℓ изменяется от 0 до n-1. Например: при n=4, ℓ может иметь 4 значения 0, 1,2 и 3, т.е. этот уровень состоит из 4-х подуровней. Используя обозначения, принятые в спектроскопии подуровни обозначают малыми буквами латинского алфавита.
| ℓ | ||||||
| s | p | d | f | q | h |
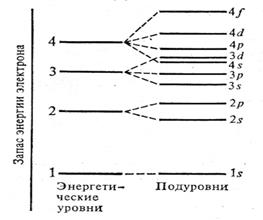
Число подуровней равно номеру уровня (n). Схема подразделения энергетических уровней на подуровни.
|
s- орбитали имеют форму шара 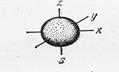 | p- орбитали имеют форму гантели 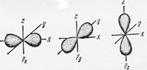 |
| f-, и d-орбитали более сложные формы розетки |
3) Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве, связано с орбитальным квантовым числом и может принимать целочисленные значения от – lдо + l через 0. Для s -подуровня ℓ = 0,ml = 0, поэтому для s - орбитали один вариант расположения в пространстве.
Для p-подуровня ℓ = 1, ml = -1, 0, +1, т.е. соответствуют три значения ml, три орбитали взаимно перпендикулярные, т.к. координированы вдоль осей x, y, z. Такие орбитали обозначаются px, py, pz.
Облакам d электронов (ℓ = 2), соответствует 5 значений магнитного квантового числа ml = –2, –1, 0, +1, +2.
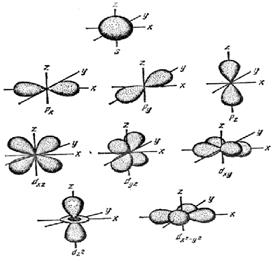
f-электронам (ℓ = 3) соответствуют 7 значений магнитного квантового числа ml = –3, –2, –1, 0, +1, +2, +3. Имеет место, соответственно, 5 и 7 различных ориентаций f-, и d-орбиталей в пространстве.

4) Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси. Может принимать всего 2 значения +½ и –½, которые отличаются как и остальные квантовые числа, на единицу. Если спин равен +½, то электрон вращается по часовой стрелке, если –½, то против часовой стрелки,(в графических формулах клетка – орбиталь, стрелка – электрон)
 ms =+1/2
ms =+1/2  ,
,  ms=-1/2
ms=-1/2  Таким образом, состояние электрона в атоме может быть описано с помощью 4-х квантовых чисел n, ℓ, ml, ms. Они характеризуют спин, энергию электрона, объём и форму пространства, в котором вероятно его пребывание около ядра.
Таким образом, состояние электрона в атоме может быть описано с помощью 4-х квантовых чисел n, ℓ, ml, ms. Они характеризуют спин, энергию электрона, объём и форму пространства, в котором вероятно его пребывание около ядра.
При переходе атома из одного квантового состояния в другое, в связи с чем меняются значения квантовых чисел, происходит перестройка электронного облака. При этом атом поглощает или испускает квант энергии.
Распределение электронов в атоме, находящемся в основном состоянии определяется зарядом ядра. При этом электроны размещаются согласно принципу наименьшей энергии. Наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии.
По принципу наименьшей энергии каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией. С ростом порядкового номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергии: уровни заполняются от 1 до 7, а подуровни в последовательности s, p, d, f. Опытным путём определена последовательность возрастания энергии − так называемая шкала энергии.
Эта шкала имеет вид, где вертикальными линейками отделены периоды.
| I | II | III | IV | V | VI | VII |
| 1s | 2s 2p | 3s 3p | 4s 3d 4p | 5s 4d 5p | 6s 4f 5d 6p | 7s 5f 6d 7p |
Принцип исключения Паули − в атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел.
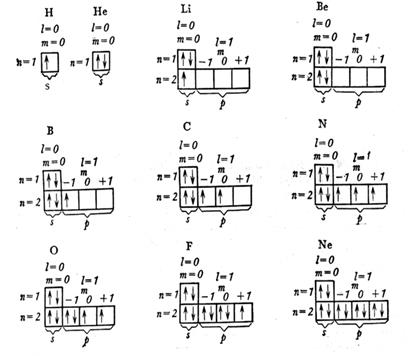
Это значит, что на орбитали, характеризуемой тремя квантовыми числами, не может быть более двух электронов. Два электрона, находящиеся на одной орбитали, отличаются друг от друга значениями спинового квантового числа, т.е. они имеют одинаковые значения n, ℓ, ml, но противоположно направлены или имеют антипараллельные спины, обозначаются противоположно направленными стрелками ↑↓ и называются спаренными. Неспаренныеэлектроны изображаются одной стрелкой  ↑, они являются валентными.
↑, они являются валентными.
Валентность − способность одного атома элемента присоединять определённое число электронов и определяется числом неспаренных электронов.
Распределение электронов по нескольким ячейкам одного подуровня происходит в соответствии с правилом Хунда: в пределах подуровня электроны заполняют наибольшее число орбиталей, в связи с чем сумма их спиновых чисел должна быть максимальной.
В электронных формулах число впереди − номер энергетического уровня, буквой выражается подуровень (тип орбитали), индекс справа вверху − число электронов на подуровне. В качестве примера рассмотрим распределение электронов в атомах элементов второго периода.
Порядок заполнения АО электронами определяется также правилом Клечковского, которое учитывает зависимость энергии орбитали от значений главного (n) и орбитального (ℓ) квантовых чисел:
АО заполняются электронами в порядке последовательного увеличения суммы n + l, а при одинаковых значениях этой суммы − в порядке последовательного возрастания главного квантового числа n.
Энергия ионизации (мера проявления металлических свойств) — это энергия, необходимая для отрыва электрона от атома. (Ca0 →Ca2+ + 2е- - ∆Н).Чем больше электронов на внешнем электронном слое, тем больше энергия ионизации. С увеличением радиуса атома энергия ионизации уменьшается. Этим объясняется уменьшение металлических свойств в периодах слева направо и увеличение металлических свойств в группах сверху вниз. Цезий (Cs) — самый активный металл. Энергия сродствак электрону (мера проявления неметаллических свойств) - энергия, которая выделяется в результате присоединения электрона к атому (Сl0 + 1е- → Сl- + ∆Н). С увеличением числа электронов на внешнем электронном слое энергия сродства к электрону увеличивается, а с увеличением радиуса атома — уменьшается. Этим объясняются увеличение неметаллических свойств в периодах слева направо и уменьшение неметаллических свойств в главных подгруппах сверху вниз.
Периодический з. Менеделеева. Структура период.системы и ее связь с электрон.структурой атомов. Периодичность в изменении электрон.конфигурации атомов. Периодичность в измени величин радиусов, эн. ионизации, сродства к электрону, электроотрицательности атомов. Периодичность в изменении св-в простых веществ и основных хим.соед.
Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в марте 1869 г. Менделеев дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».Графическим (табличным) выражением периодического закона является разработанная Менделеевым периодическая система элементов. Физический смысл химической периодичности: периодические изменения свойств хим. элементов обусловлены правильным повторением электрон. конфигурации внеш. энергетич. уровня (валентных электронов) их атомов с увеличением заряда ядра. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Номер периода обозначает число энергетических уровней в атоме элемента. Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов.У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях. Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне). В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды). В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам. Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы). Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
Радиус атома орбитальный - теоретически рассчитанное положение главного максимума плотности внешних электронных облаков. Практически приходится пользоваться эффективным. Эффективный радиус - 1/2 расстояния между ядрами атомов химически связанных элементов. В периодах атомные радиусы по мере увеличения заряда ядра, в общем, уменьшаются, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, притяжение им электронов. В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных уровней.
Энергия ионизации (мера проявления металлических свойств) — это энергия, необходимая для отрыва электрона от атома. (Ca0 →Ca2+ + 2е- - ∆Н).Чем больше электронов на внешнем электронном слое, тем больше энергия ионизации. С увеличением радиуса атома энергия ионизации уменьшается. Этим объясняется уменьшение металлических свойств в периодах слева направо и увеличение металлических свойств в группах сверху вниз. Цезий (Cs) — самый активный металл. Энергия сродствак электрону (мера проявления неметаллических свойств) - энергия, которая выделяется в результате присоединения электрона к атому (Сl0 + 1е- → Сl- + ∆Н). С увеличением числа электронов на внешнем электронном слое энергия сродства к электрону увеличивается, а с увеличением радиуса атома — уменьшается. Этим объясняются увеличение неметаллических свойств в периодах слева направо и уменьшение неметаллических свойств в главных подгруппах сверху вниз.
Электроотрицательность (ЭО). Способность атомов в соединениях притягивать к себе электроны. Возрастает по периоду, убывает по группам у элементов I, II, V, VI и VII главных подгрупп, III, IV и V – побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы (минимум у Al), возрастает с увеличением номера периода у элементов VII – VIII побочных подгрупп. Наименьшие значения s-элементы I подгруппы, наибольшие значения – p-элементы VI и VII групп. Понятие (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно Малликену, электроотрицательность атома может быть выражена как полусумма его энергии ионизации и сродства к электрону: ЭО = 1/2 (I + F). В периодах наблюдается общая тенденция роста величины электроотрицательности, а в группах - ее падения.
 2015-08-12
2015-08-12 2155
2155
