Елементарною структурною одиницею білкової молекули є амінокислота. У природі виявлено близько 100 різних амінокислот, але тільки 20-22 з них входять до складу білків організму людини та харчових продуктів, близько 10 зустрічається рідко, а інші входять до складу деяких фізіологічних небілкових сполук (гормонів, антибіотиків та ін.) або містяться у рослинних і тваринних організмах у вільному стані.
Усі амінокислоти поділяються за хімічною структурою на дві групи: ациклічні (жирного ряду) і циклічні (ароматичного ряду). Більшість амінокислот має ациклічну структуру.
Будь-яка амінокислота у своєму складі обов'язково має дві головні функціональні групи: карбоксильну (СООН) і аміногрупу (NH2). Крім того, амінокислоти можуть мати гідроксильні радикали, ароматичні кільця, сульфгідрильні групи та ін.
Більшість амінокислот — це α-амінокислоти, але зустрічаються і β-амінокислоти (β-аланін). Водні розчини амінокислот можуть мати нейтральну, слабокислу або слаболужну реакцію середовища. Це залежить від того, скільки і яких функціональних груп (NH2) і (СООН) входить до складу амінокислоти. Залежно від кількості аміно- і карбоксильних груп у молекулі амінокислоти розпізнають моноаміномонокарбонові кислоти (валін, аланін, гліцин, метіонін, лейцин, ізолейцин), моноамінодикарбонові (аспарагінова, глютамінова) кислоти, диаміномонокарбонові (лізин, аргінін, орнітин), диамінодикарбонові (цистин).
|
|
|
Замінні амінокислоти - частина амінокислот які можуть утворюватися в організмі людини внаслідок процесів взаємного перетворення (глютамінова кислота, цистин, цистеїн, пролін).
Незамінні амінокислоти – амінокислоти які не можуть утворюватися в організмі людини, а повинні надходити з харчовими продуктами. Для дорослої людини їх 8 (лізин, лейцин, ізолейцин, валін, метіонін, триптофан, фенілаланін, треонін), а для дітей додатково (гістидин і аргінін).
На основі вивчення амінокислотного складу багатьох білків встановлено, що такі амінокислоти, як фенілаланін, пролін, тирозин, лейцин, ізолейцин, глютамінова кислота майже постійно зустрічаються в білках. Такі ж амінокислоти, як лізин, метіонін, аргінін, гістидин, зустрічаються значно рідше. Але це загальне положення не завжди можна застосувати до окремих специфічних білків. Так, наприклад, протаміни відзначаються високим вмістом аргініну (до 80%) і майже повною відсутністю лейцину та глютамінової кислоти. Для гістонів характерним є високий вміст аргініну і лізину і майже повна відсутність триптофану і цистину.
Залежно від амінокислотного складу білки бувають повноцінними і неповноцінними.
Повноцінні білки - в своєму складі мають всі незамінні амінокислоти в оптимальному співвідношенні. Згідно з формулою ФАО (комітет ООН з продовольства і сільського господарства), оптимальне співвідношення незамінних амінокислот в молекулі повноцінного білка повинно бути таким: триптофан - 1, лейцин - 3-4, ізолейцин - 3, валін - 3, лізин - 3, метіонін - 3, фенілаланін - 4, треонін - 2.
|
|
|
Нестача в раціоні харчування тієї чи іншої амінокислоти впливає в першу чергу на регенерацію білків.
При відсутності валіну порушується координація рухів.
Ізолейцин потрібен для нормального росту молодого організму.
Лейцин дуже поширений у рослинних і тваринних білках, особливо багато його утворюється при проростанні зерна. При нестачі цієї амінокислоти затримується ріст молодого організму, зменшується маса тіла.
Лізин — важлива незамінна амінокислота. Нестача лізину в їжі призводить до порушення кровотворення, зменшення кількості еритроцитів і зниження в них гемоглобіну, порушення кальцифікації кісток.
Метіонін відіграє важливу роль в азотистій рівновазі в організмі. У молекулі метіоніну є легкорухлива метильна група, яка може порівняно легко передаватися на інші сполуки.
Треонін відіграє важливу роль в розвитку тваринних організмів. Нестача треоніну призводить до зменшення маси тіла і навіть до загибелі тварини.
Триптофан потрібен для утворення гемоглобіну, нормального росту організму. Головним джерелом триптофану є білки молока, м'яса, яєць, бобових.
Фенілаланін відіграє важливу роль у діяльності щитоподібної залози, він утворює ядро в процесі синтезу гормону тироксину.
Для визначення біологічної цінності білків використовують такий показник, як амінокислотний скор, який дозволяє виявити лімітовані незамінні амінокислоти. Визначення лімітованих амінокислот і ступеня їх нестачі проводиться шляхом порівнювання відсоткового вмісту амінокислот в досліджуваному білку і в такій же кількості умовно ідеального білка. Еталонами ідеального білка вважають білки материнського молока, курячого яйця і коров'ячого молока.
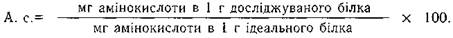
Усі амінокислоти, скор яких менше 100%, вважаються лімітованими, а амінокислота з найменшим скором є головною лімітованою амінокислотою (табл.2.9).
Таблиця 2.9
Амінокислотний скор білків коров'ячого молока
| Назва амінокислоти | Жіноче молоко, АК1 | Коров'яче молоко | |
| АК1 | С3 | ||
| Ізолейцин | 4,6 | 4,7 | |
| Лейцин | 9,3 | 9,5 | |
| Лізин | 6,6 | 7,8 | |
| Метіонін+цистин | 4,2 | 3,3 | |
| Фенілаланін+тирозин | 7,2 | 10,2 | |
| Треонін | 4,3 | 4,4 | |
| Триптофан | 1,7 | 1,4 | |
| Валін | 5,5 | 6,4 | |
| Гістидин | 2,6 | 2,7 |
АК — кількість амінокислот на 100 г білка, г;
С — скор відносно білків жіночого молока, %.
У зв'язку з тим, що молекула амінокислоти у своєму складі має дві головні групи (NH2) і (СООН), ще в 1888 р. видатний хімік Л.Я.Данилевський висловив припущення, що при утворенні білка амінокислоти з'єднуються між собою ковалентним пептидним зв'язком. Це припущення було підтверджено в 1902 р. німецьким біохіміком Е.Фішером.
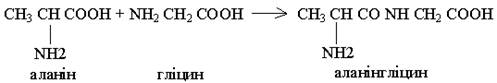
Пізніше, було встановлено що, крім пептидних зв'язків, при утворенні ланцюга амінокислот, які у своєму складі мають сірку, виникає дисульфідний зв'язок внаслідок окиснення сульфгідрильних груп.

Білок — це високомолекулярна сполука, яка складається із залишків амінокислот, з'єднаних між собою пептидним зв'язком або дисульфідним містком.
Білки мають важливу особливість: кожній амінокислоті в молекулі білка відповідає суворо визначене місце. Він має кілька рівнів організації структури своєї молекули.
АК – кількість амінокислот на 100 г білка, г; С – скор відносно білків жіночого молока, %.
Амінокислотний склад білка і послідовність розміщення амінокислот в поліпептидних ланцюжках називають первинною структурою білка.
У зв'язку з тим, що амідна група, яка входить до пептидного зв'язку, має атом водню, це забезпечує можливість утворення водневого зв'язку. Він може виникати як між окремими поліпептидними ланцюжками, так і між кільцями одного ланцюга. Чим більше водневих зв'язків утворюється в молекулі білка, тим нижча її енергія, тим вища її стабільність.
|
|
|
Тому поліпептидні ланцюжки прагнуть утворити впорядковані жорсткі α-спіралі з максимально можливою кількістю водневих зв'язків. Ці спіралі нагадують різьбу гвинта, на одному витку якого вміщується 3,6 амінокислотного залишку, тобто водневі зв'язки у спіралі виникають через три амінокислоти на четверту.
Але деякі амінокислоти не можуть укластись у спіральну конформацію. Якщо в поліпептидному ланцюгу зустрічається така амінокислота, то спіраль повинна перерватися, а поліпептидний ланцюг у цьому місці мусить набрати якоїсь іншої конформації.
Іншим варіантом з'єднання поліпептидних ланцюгів є виникнення міжмолекулярних водневих зв'язків, які з'єднують сусідні поліпептидні ланцюги або ділянки білкової молекули. При цьому утворюється складчаста (β-структура). Поліпептидні ланцюги в цій структурі витягнуті, а пептидні групи лежать в одній площині. Так, наприклад, молекула колагену (білок сполучної тканини м'яса) являє собою три поліпептидні витягнуті ланцюги, з'єднані між собою міжланцюговими водневими зв'язками.
Спіральна або складчаста структура макромолекули, обумовлена утворенням водневих зв'язків, називається вторинною структурою білка.
Міоглобін, гемоглобін, овоальбумін значною мірою побудовані з α-спіралей, у той час як β-лактоглобулін, β-хімотрипсин, пепсин - в основному неспіральні.
Цілий ряд властивостей білкової молекули (ферментативна атакованість, термолабільність) залежать від її вторинної структури. Найбільш складні й тонкі особливості структури, які відрізняють один білок від одного, пов'язані з орієнтацією білкової молекули у просторі. Молекули багатьох білків мають округлу форму, тобто спіральні структури укладені або згорнуті в компактні глобули. Таке укладення стабілізується рядом вторинних зв'язків, які виникають між боковими радикалами амінокислотних залишків. До них належать дисульфідні зв'язки, гідрофобні взаємодії (сили Вандер-Ваальса) між неполярними радикалами, електростатичні сили взаємодії між полярними групами, сольові зв'язки та ін.
|
|
|
Головну роль у стабілізації цього рівня організації макромолекул відіграє не пептидний скелет, а бокові ланцюги амінокислот.
Конфігурація поліпептидної спіралі у просторі визначає третинну структуру білка.
Дослідники вважають, що третинна структура виникає автоматично, як наслідок взаємодії амінокислотних радикалів з молекулами розчинника. При цьому кожна спіраль в певних умовах укладається тільки одним способом, набуваючи тієї форми, яка характерна для молекул природного білка.
Третинна структура визначає зовнішню форму білкової молекули (глобулярну чи фібрилярну). Глобулярні білки молока, яйця, міоглобін, фібрилярні — колаген м'яса і риби, кератин волосся, нігтів, фіброїн шовку.
При побудові четвертинної структури білкові субодиниці є ніби «цеглинками», з яких будується значно більша компактна глобула. Як правило, в такі мультимери об'єднуються неактивні молекули, які завдяки саме такій сполуці утворюють функціонально активну одиницю.
Четвертинна структура являє собою більш складну конфігурацію, бо молекула білка складається з кількох субодиниць, кожна з яких займає фіксоване положення у просторі, внаслідок чого білок набуває біологічної активності.
Об'єднання субодиниць в мультимер відбувається самовільно. Число субодиниць (протомерів, які входять у мультимер), різне — від чотирьох (у молекулі гемоглобіну) до кількох тисяч (білок вірусу тютюнової мозаїки). Четвертинна структура утворюється при виникненні ковалентних іонних зв'язків і слабких сил взаємодії між окремими функціональними групами, які містяться на поверхні глобул.
Часто четвертинна структура білка є основою його біологічної активності. Але треба підкреслити, що функціональна активність того чи іншого білка визначається не тільки четвертинною структурою, а всіма чотирма рівнями її організації. Усі ці рівні структури взаємно впливають один на одного, причому нижчий порядок організації визначає вищий.
 2015-09-07
2015-09-07 2161
2161
