Таблица 1. Коэффициенты активности различных ионов
Коэффициенты активности ионов используют во всех случаях, когда требуется перейти от термодинамической константы равновесия К 0 (табличная величина, выражается через активности исходных веществ и продуктов реакции) к реальной константе К (выражается через равновесные концентрации).
Для обратимой химической реакции
aA + bB ↔ cC + dD
соотношение между термодинамической и реальной константами равновесия имеет вид:
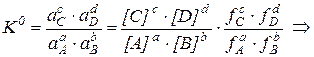
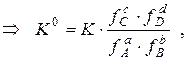
где а – активности веществ; f – коэффициенты активности.
l Пример 1. В насыщенном растворе малорастворимой соли Ca3(PO4)2 устанавливается равновесие между осадком и раствором:
Ca3(PO4)2↓ ↔ 3Ca2+ + 2PO43–,
которое описывается константой – произведением растворимости. В табл. 6 приведено термодинамическое значение ПР0 = 2,0·10–29. Оно пригодно для расчёта растворимости соли, если ионная сила μ = 0.
Для расчёта растворимости в присутствии постороннего сильного электролита необходимо воспользоваться реальной константой (ПР), которая вычисляется на основании табличных величин – значения ПР0 и значений коэффициентов активности ионов осадка при данной ионной силе.
В табл. 1 находим значения коэффициентов активности ионов кальция (II) и фосфат-ионов при μ = 0,1:
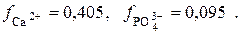
Тогда:
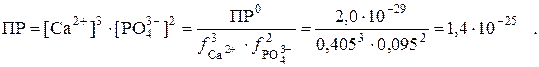
Если в таблице отсутствуют данные о значении коэффициента активности какого-либо иона для конкретного значения ионной силы, то значение f рассчитывают по эмпирическим уравнениям Дебая –Хюккеля и Дэвиса с учётом закона ионной силы Льюиса и Рендалла:
«В достаточно разбавленных растворах с одинаковой ионной силой коэффициенты активности большинства одинаково заряженных ионов приблизительно одинаковы».
Таблица 1
 2015-09-06
2015-09-06 362
362








