При изучении материального мира принято выделять исследуемый объект (мысленно или реально) и называть его системой, а все остальное рассматривать как окружающую среду. Система может быть изолирована от окружающей среды или взаимодействовать с ней. Она может состоять из отдельной частицы (молекулы, атома, электрона и т.д.) или из многих частиц (определенного количества газа, жидкости, твердого вещества и т.д.). Статистическая физика изучает только системы, состоящие из большого числа частиц. Такие системы называют макроскопическими системами: их называют также термодинамическими системами. Число частиц N системы считается большим, если имеет место неравенство 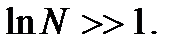 Этому условию удовлетворяет, например, указанное выше число молекул в одном моле (число Авогадро
Этому условию удовлетворяет, например, указанное выше число молекул в одном моле (число Авогадро 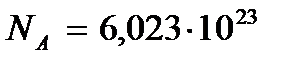 моль–1). Размеры макроскопических систем значительно больше размеров атомов и молекул.
моль–1). Размеры макроскопических систем значительно больше размеров атомов и молекул.
Важнейшим понятием, характеризующим систему, является понятие состояния системы. Этим термином обозначают совокупность всех свойств системы, которые обычно определяются некоторыми количественными характеристиками – физическими величинами, называемыми параметрами состояния. Такими параметрами являются, например, плотность, объем V, занимаемый некоторой массой m вещества, концентрация, поляризованность, намагниченность, давление p, температура T и др. Указанная здесь температура называется термодинамической температурой, или абсолютной температурой. Она связана с температурой по шкале Цельсия, 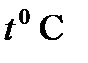 соотношением
соотношением 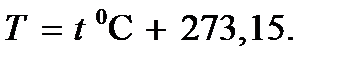
|
|
|
Параметры, характеризующие систему, подразделяются на внешние и внутренние. К внешним параметрам относятся такие параметры, которые определяются положением внешних тел. Такими параметрами являются, например, объем системы, напряженность силового поля и др. К внутренним параметрам относятся параметры, которые определяются совокупным движением и распределением в пространстве входящих в систему частиц (например, энергия, давление, плотность, поляризованность, намагниченность и др.)
Параметры состояния взаимосвязаны, так что изменение одного из них влечет в общем случае изменение других. Иначе говоря, параметры состояния связаны между собой определенной функциональной зависимостью: 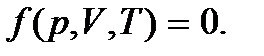 Соотношение, устанавливающее связь между параметрами состояния, находящимися в состоянии равновесия, называется уравнением состояния. Зная состояние системы, можно найти различные функции состояния – физические характеристики, которые зависят только от состояния системы (от параметров состояния); они принимают те же значения каждый раз, когда система оказывается в данном состоянии независимо от ее предыстории.
Соотношение, устанавливающее связь между параметрами состояния, находящимися в состоянии равновесия, называется уравнением состояния. Зная состояние системы, можно найти различные функции состояния – физические характеристики, которые зависят только от состояния системы (от параметров состояния); они принимают те же значения каждый раз, когда система оказывается в данном состоянии независимо от ее предыстории.
|
|
|
Переход системы из одного состояния в другое через некоторую последовательность промежуточных состояний называют процессом. Состояние системы называют равновесным, если параметры, характеризующие ее состояние при отсутствии внешних воздействий, остаются постоянными сколь угодно долго. При несоблюдении этого условия состояние системы будет неравновесным. В статистической физике под состоянием системы всегда подразумевается равновесное состояние системы. Равновесное состояние системы всегда можно изобразить точкой на координатной плоскости, если по осям координат откладывать значения каких-либо параметров, характеризующих систему. Неравновесное состояние графически изобразить таким способом нельзя, так как в этом случае параметры не имеют определенных значений. Существование термодинамического (статистического) равновесия является одним из постулатов статистической физики. Другим важнейшим постулатом является утверждение о том, что любая система, выведенная из состояния равновесия и предоставленная самой себе, снова возвращается в какое-то (другое) состояние равновесия. Процесс перехода системы в равновесное состояние называется релаксацией, а время такого перехода – временем релаксации.
Любой процесс перехода системы из одного равновесного состояния в другое всегда связан с нарушением равновесия системы. Это нарушение может быть вызвано только изменением внешних условий. Если в ходе процесса изменение параметров со временем происходит так, что в любой момент времени состояние системы можно охарактеризовать определенными значениями параметров, то такой процесс называют равновесным. Равновесный процесс состоит из непрерывной последовательности равновесных состояний. Равновесным может быть только бесконечно медленно протекающий процесс. На координатной плоскости равновесный процесс графически можно изобразить непрерывной линией, каждая точка которой – условно равновесное промежуточное состояние системы. Процесс называют обратимым, если он допускает возвращение системы в первоначальное состояние (при изменении внешних условий на противоположные), причем так, что система проходит в обратном порядке через ту же последовательность промежуточных состояний, что и при прямом процессе, но без того, чтобы в окружающей среде остались какие-либо изменения. Иными словами, процесс обратим, если при совершении его системой сначала в прямом, а затем в обратном направлении в исходное состояние возвращаются как сама система, так и все внешние тела, с которыми система взаимодействует.Всякий неудовлетворяющий этому условию процесс называется необратимым. Все равновесные процессы являются обратимыми, а неравновесные – необратимыми. Обратимость равновесных процессов обусловлена тем, что при таких процессах состояние системы в каждый момент полностью определяется внешними параметрами и температурой, поэтому при равновесных изменениях этих параметров в обратном порядке система также в обратном порядке пройдет все состояния и придет в начальное состояние, не вызвав никакого изменения в окружающих телах.
Равновесные и обратимые процессы являются идеализацией; все реальные превращения в природе являются неравновесными и необратимыми, и их протекание в обратном направлении сопровождается остаточными изменениями в окружающей среде. Необратимыми процессами являются все процессы перехода системы к равновесному состоянию. Процесс, при котором термодинамическая система, выйдя из какого-либо состояния и пройдя через ряд промежуточных состояний, снова возвращается в исходное состояние (но другим путем), называется круговым процессом, или циклом. Графически круговой равновесный процесс изображается замкнутой кривой.
|
|
|
По способу передачи энергии, вещества и информации между рассматриваемой системой и окружающей средой термодинамические системы подразделяются на следующие классы.
1. Замкнутые или изолированные системы - системы, которые не могут обмениваться с окружающей средой ни энергией, ни веществом (в том числе и излучением), ни информацией.
2. Адиабатно изолированные или просто адиабатные системы – системы, которые не могут обмениваться энергией в форме теплоты.
3. Закрытые системы – системы, которые не могут обмениваться веществом.
4. Открытые системы – системы, которые могут обмениваться энергией, веществом и информацией.
 2015-09-06
2015-09-06 1641
1641
