Глава 7
РЕАЛЬНЫЕ ГАЗЫ И ЖИДКОСТИ
Реальные газы. Уравнение Ван-дер-Ваальса
Уравнение состояния идеального газа удовлетворительно описывает поведение реальных газов только лишь при достаточно высоких температурах и сравнительно низких давлениях. С понижением температуры и увеличением давления реального газа отклонения от уравнения состояния идеального газа становятся весьма значительными. Такое отклонение свойств реальных газов от свойств идеального газа свидетельствует о том, что не всегда можно пренебречь размерами молекул газа и их взаимодей-
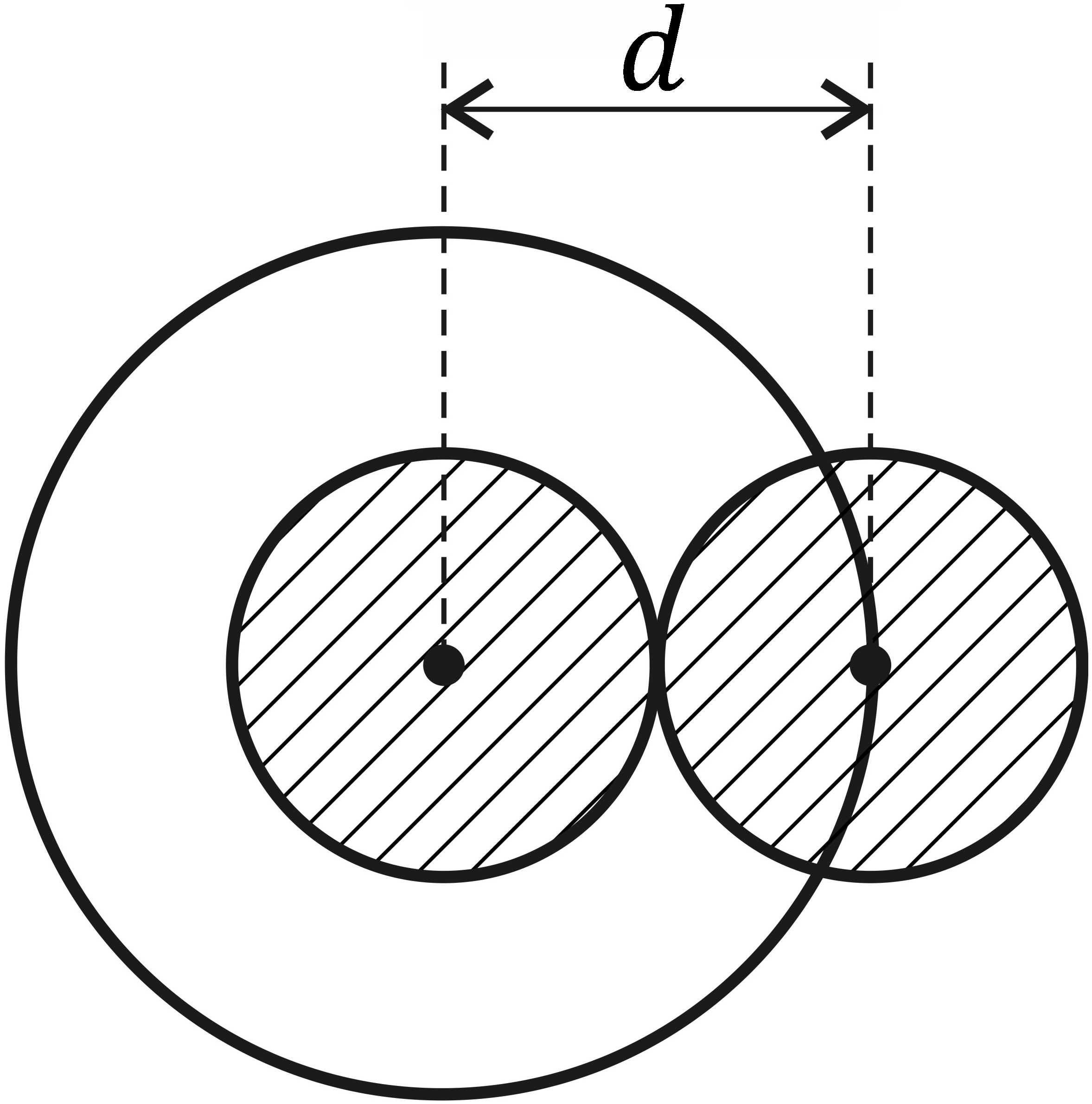 Рис. 7.1 Рис. 7.1 |
ствием на расстоянии (а именно при условии таких пренебрежений и было получено уравнение состояния идеального газа). При увеличении давления растет плотность газа и уменьшается среднее расстояние между молекулами. При этом все большую роль начинают играть собственный объем молекул и взаимодействия между ними.
Уравнение состояния реального газа, учитывающее как собственный объем молекул (который в кинетической теории идеального газа считается пренебрежимо малым по сравнению с объемом газа), так и силы взаимодействия между молекулами, зависящие от расстояния между ними, было получено Ван-дер-Ваальсом. Это уравнение является скорректированным уравнением идеального газа. В модели газа Ван-дер-Ваальса, как и в модели идеального газа, молекулы представляются в виде несжимаемых (твердых) шаров диаметром d. Поскольку центры молекул не могут сблизиться друг с другом на расстояние, меньшее суммы радиусов молекул, т.е. меньшее их диаметра d, то вокруг каждой молекулы существует «запрещенный объем» в виде шара радиуса d, внутрь которого не может проникнуть центр другой молекулы (рис. 7.1). Этот запрещенный объем равен 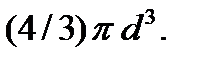 Но так как в столкновении участвуют две молекулы, запрещенный объем, приходящийся на одну молекулу, будет равен
Но так как в столкновении участвуют две молекулы, запрещенный объем, приходящийся на одну молекулу, будет равен
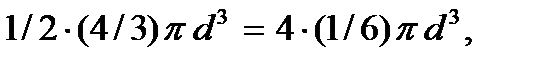
т.е. равен учетверенному объему одной молекулы. Запрещенный объем, приходящийся на один моль, будет равен
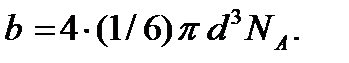
Этот объем недоступен для свободного движения молекул. Для свободного движения молекул остается объем, равный 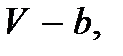 и именно он должен фигурировать в уравнении состояния. Это приводит к следующей корректировке уравнения состояния идеального газа:
и именно он должен фигурировать в уравнении состояния. Это приводит к следующей корректировке уравнения состояния идеального газа:
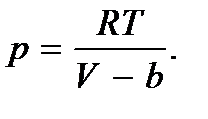
Поправка b на собственный объем молекул газа учитывает в первом приближении действие сил межмолекулярного отталкивания.
а) б)
Рис. 7.2
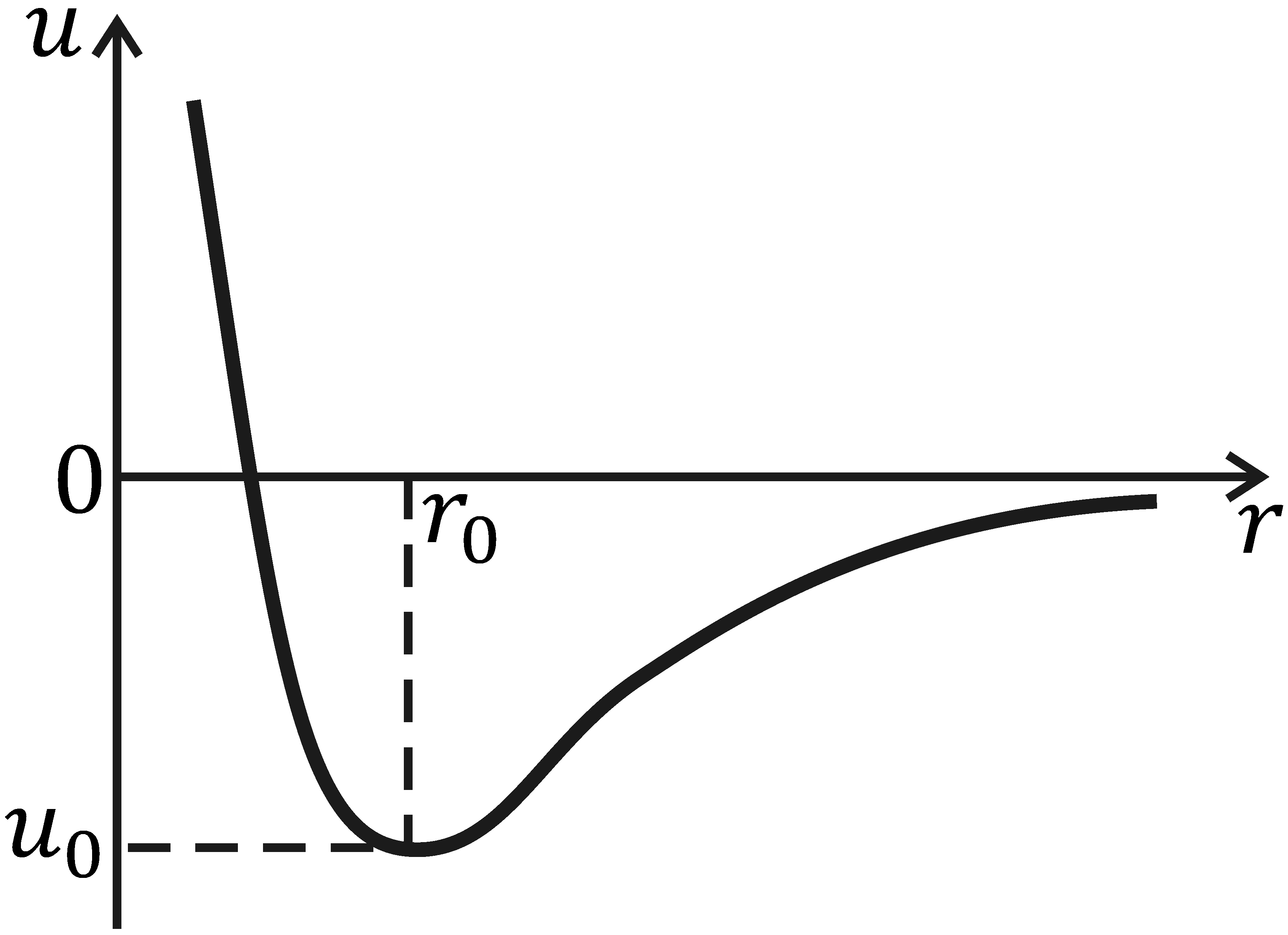
На рис. 7.2, а представлен график зависимости энергии взаимодействия u молекул от расстояния r между ними. При 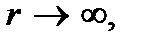 т.е. на расстоянии, на котором молекулы не взаимодействуют, энергия взаимодействия принята равной нулю, т.е.
т.е. на расстоянии, на котором молекулы не взаимодействуют, энергия взаимодействия принята равной нулю, т.е. 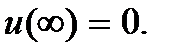 Расстояние r 0 между молекулами соответствует минимуму их потенциальной энергии. Это расстояние примерно равно диаметру молекулы. На меньших расстояниях (
Расстояние r 0 между молекулами соответствует минимуму их потенциальной энергии. Это расстояние примерно равно диаметру молекулы. На меньших расстояниях (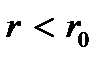 ) кривая u (r) круто поднимается вверх; эта область соответствует сильному отталкиванию молекул. Действительно, в этой области сила, действующая на вторую молекулу,
) кривая u (r) круто поднимается вверх; эта область соответствует сильному отталкиванию молекул. Действительно, в этой области сила, действующая на вторую молекулу, 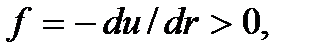 т.е. направлена в противоположную сторону от первой молекулы. На расстояниях
т.е. направлена в противоположную сторону от первой молекулы. На расстояниях 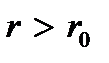 сила, действующая на вторую молекулу,
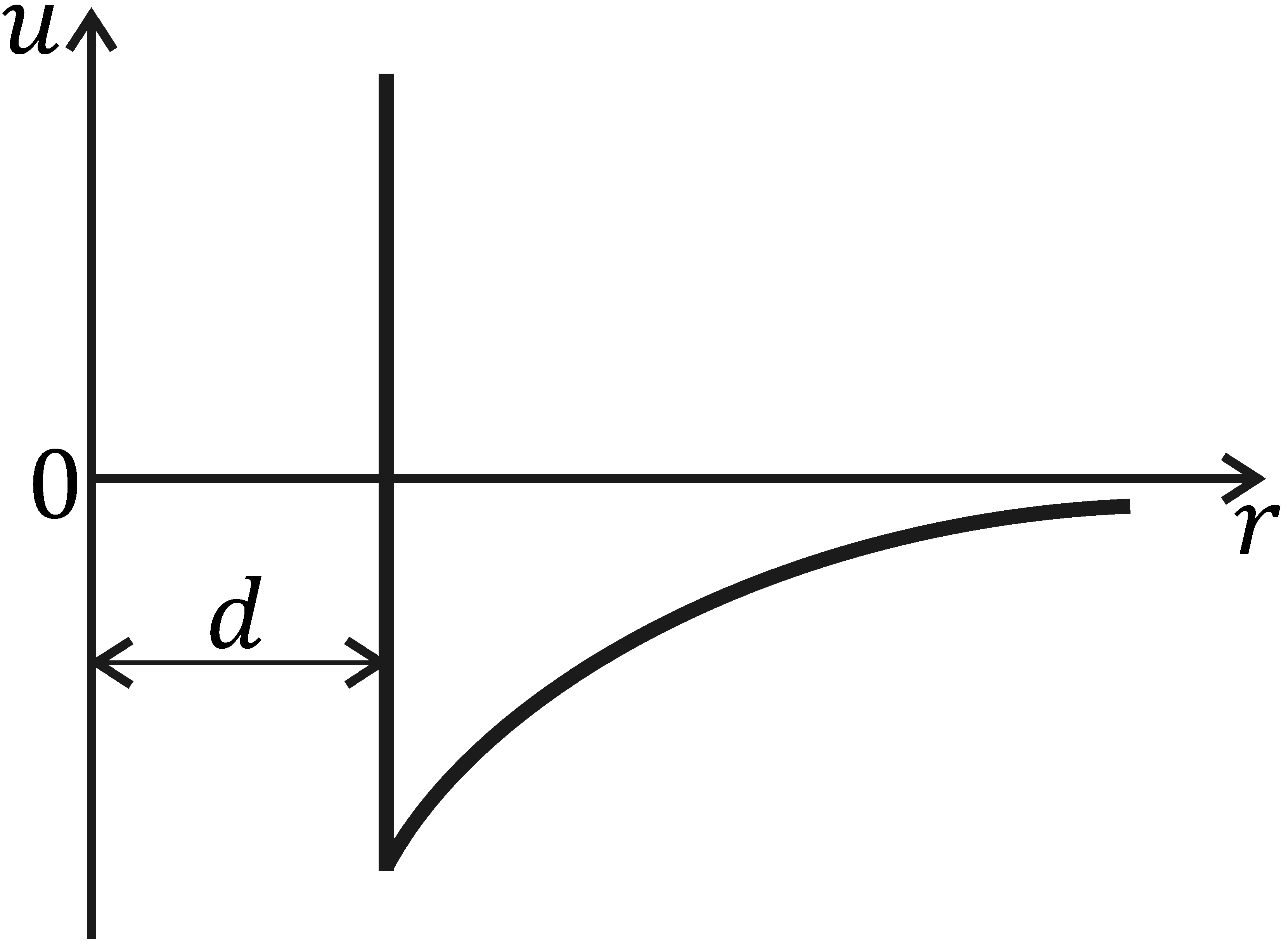
сила, действующая на вторую молекулу, 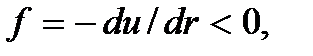 т.е. направлена в сторону первой молекулы. Поэтому указанная область соответствует притяжению молекул. Силы отталкивания обусловлены главным образом кулоновским отталкиванием перекрывающихся электронных оболочек молекул, а силы притяжения – взаимной электрической поляризацией двух молекул. В модели Ван-дер-Ваальса потенциальная энергия отталкивания заменяется бесконечно большой энергией отталкивания твердых шаров. Энергия притяжения принимается обратно пропорциональной пятой степени расстояния: u ~
т.е. направлена в сторону первой молекулы. Поэтому указанная область соответствует притяжению молекул. Силы отталкивания обусловлены главным образом кулоновским отталкиванием перекрывающихся электронных оболочек молекул, а силы притяжения – взаимной электрической поляризацией двух молекул. В модели Ван-дер-Ваальса потенциальная энергия отталкивания заменяется бесконечно большой энергией отталкивания твердых шаров. Энергия притяжения принимается обратно пропорциональной пятой степени расстояния: u ~ 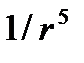 , так что в модели Ван-дер-Ваальса
, так что в модели Ван-дер-Ваальса
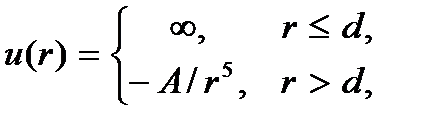
где 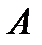 – постоянная. При этом потенциальная энергия взаимодействия принимает вид, изображенный на рис. 7.2, б. Таким образом, каждая молекула рассматривается как твердая упругая сфера диаметром d, окруженная полем сил притяжения с энергией взаимодействия, пропорциональной
– постоянная. При этом потенциальная энергия взаимодействия принимает вид, изображенный на рис. 7.2, б. Таким образом, каждая молекула рассматривается как твердая упругая сфера диаметром d, окруженная полем сил притяжения с энергией взаимодействия, пропорциональной 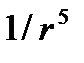 . Сила притяжения при этом будет пропорциональна шестой степени расстояния: f ~
. Сила притяжения при этом будет пропорциональна шестой степени расстояния: f ~ 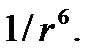
Наличие сил притяжения между молекулами приводит к тому, что на молекулу, подлетающую к стенке сосуда, действуют другие молекулы, находящиеся от нее на расстояниях, меньших радиуса действия межмолекулярных сил. Эти молекулы притягивают к себе рассматриваемую молекулу, тормозя ее движение, и как бысмягчают ее удар о стенку.Вследствие этого уменьшается импульс, переданный стенке молекулой, а значит, и давление газа на стенку сосуда. Предполагается, что результирующая всех сил, действующих на каждую молекулу вблизи стенки, пропорциональна числу молекул в полусфере, радиус которой по порядку равен радиусу действия межмолекулярных сил 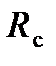 : F ~ ~
: F ~ ~ 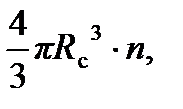 где n – концентрация молекул газа. Сила эта направлена от стенки в сторону газа. Число подлетающих к стенке молекул также пропорционально концентрации n. Поэтому из-за притяжения молекул давление газа на стенку сосуда должно уменьшиться на величину pi ~ n 2 =
где n – концентрация молекул газа. Сила эта направлена от стенки в сторону газа. Число подлетающих к стенке молекул также пропорционально концентрации n. Поэтому из-за притяжения молекул давление газа на стенку сосуда должно уменьшиться на величину pi ~ n 2 = 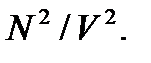 Обозначив коэффициент пропорциональности через а, будем иметь
Обозначив коэффициент пропорциональности через а, будем иметь Величину pi называют внутренним давлением. Эту величину следует вычесть из давления газа p на стенку. Тогда получим
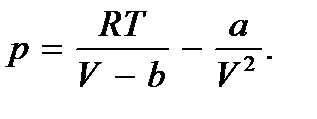 (7.1)
(7.1)
Перепишем это соотношение в виде
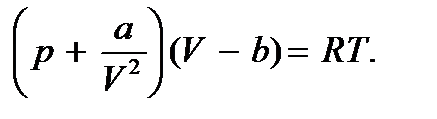 (7.2)
(7.2)
Скорректированное таким образом уравнение состояния идеального газа и есть уравнение Ван-дер-Ваальса. Оно справедливо для одного моля реального газа. Величины b и 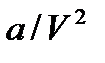 называют поправками Ван-дер-Ваальса, а коэффициенты a и b – константами (или постоянными) Ван-дер-Ваальса. Для разных газов эти константы имеют различные значения и определяются опытным путем.
называют поправками Ван-дер-Ваальса, а коэффициенты a и b – константами (или постоянными) Ван-дер-Ваальса. Для разных газов эти константы имеют различные значения и определяются опытным путем.
Для 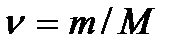 молей это уравнение будет иметь вид
молей это уравнение будет иметь вид
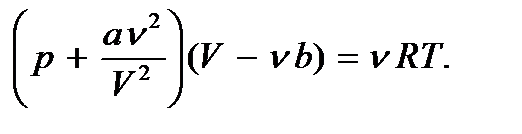 (7.3)
(7.3)
Здесь V – объем массы m газа. При получении уравнения (7.3) было учтено, что если в объеме 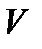 находится
находится 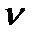 молей газа, то каждый моль занимает объем
молей газа, то каждый моль занимает объем 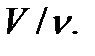
Таким образом, в отличие от уравнения состояния идеального газа, уравнение Ван-дер-Ваальса учитывает, хотя и в первом приближении, как собственный объем молекул, так и силы межмолекулярного взаимодействия на расстоянии. По этой причине указанные силы часто называют ван-дер-ваальсовыми силами. Однако, по существу, они являются упрощенной моделью реальных сил межмолекулярного взаимодействия.
Из соотношения (7.1) видно, что давление реального газа при определенных температуре и объеме может обратиться в нуль. Это значит, что при достаточном охлаждении и сжатии газ должен превратиться в жидкость, а затем затвердеть, приобретя вполне определенный объем. Это важное следствие из уравнения Ван-дер-Ваальса полностью подтверждается опытом. При этом уравнение Ван-дер-Ваальса довольно хорошо описывает поведение вещества при сжижении, но оказывается неприменимым к процессу затвердевания
.
 2015-09-06
2015-09-06 3774
3774